Как правильно понимать химические формулы?
При записи химических формул нередко встречаются цифры, которые записывают перед химической формулой.
Например, 2Na, или 5О2. Что обозначают эти цифры и для чего они нужны? Цифры, записанные перед химической формулой, называют коэффициентами.
Коэффициенты показывают общее количество частиц вещества: атомов, молекул, ионов.
Коэффициент – число, которое показывает общее количество частиц.
Коэффициент записывается перед химической формулой вещества молекул кислорода
Обратите внимание, что молекулы не могут состоять из одного атома, минимальное количество атомов в молекуле – два
- Таким образом, записи: 2Н, 4P обозначают два атома водорода и четыре атома фосфора соответственно.
- Запись 2Н2 обозначает две молекулы водорода, содержащие по два атома элемента водорода.
- Запись 4S8 – обозначает четыре молекулы серы, каждая из которых содержит восемь атомов элемента серы.
- Подобная система обозначений количества частиц используется и для ионов. Запись 5K+ обозначает пять ионов калия.
Стоит отметить, что ионы могут быть образованы не только атомом одного элемента.
Ионы, образованные атомами одного химического элемента, называют простыми: Li+, N3−.
Ионы, образованные несколькими химическими элементами, называют сложными: OH⎺, SO4 2−
Обратите внимание, что заряд иона обозначают верхним индексом.. А что будет обозначать запись 2NaCl?
А что будет обозначать запись 2NaCl?
Если на этот вопрос ответить – две молекулы поваренной соли, то ответ не правильный. Поваренная соль, или хлорид натрия, имеет ионную кристаллическую решетку, то есть это ионное соединение и состоит из ионов Na+ и Сl⎺. Пару этих ионов называют формульной единицей вещества. Таким образом, запись 2NaCl обозначает две формульных единицы хлорида натрия. Термин формульная единица используют так же и для веществ атомного строения.
Формульная единица – наименьшая частица вещества немолекулярного строения Ионные соединения так же электронейтральны, как и молекулярные. Значит, положительный заряд катионов полностью уравновешен отрицательным зарядом анионов. Например, какова формульная единица вещества, состоящего из ионов Ag+ и PO4 3−? Очевидно, что для компенсации отрицательного заряда иона (заряд –3), необходимо иметь заряд +3. С учетом того, что катион серебра имеет заряд +1, то таких катионов понадобиться три. Значит формульная единица (формула) данного вещества – Ag3PO4.
Таким образом, при помощи символов химических элементов, индексов и коэффициентов, можно четко составить химическую формулу вещества, которая даст информацию, как о качественном, так и о количественном составе вещества.
В завершение рассмотрим, как правильно произносить химические формулы. Например, запись 3Ca2+ произносится: «три иона кальций два плюс» или «три иона кальция с зарядом два плюс». Запись 4НСl, произносится «четыре молекулы аш хлор». Запись 2NaCl, произносится как «две формульных единицы хлорида натрия».
Структура таблицы элементов
Для каждого элемента в таблице отведено место (клетка), они четко пронумерованы. Расположение проведено по мере возрастания атомных масс. Все выстроенные элементы были разделены Менделеевым на ряды, начинающиеся со щелочного металла, а заканчивающиеся галогеном (благородные газы в то время не были открыты). Ряды принято называть периодами. Валентность атомов в кислородных соединениях в них увеличивается, металлические свойства элементов и простых веществ уменьшаются, а неметаллические увеличиваются.
Ряды по вертикали имеют название — группы. Представители групп имеют одинаковую высшую валентность, формулы высших оксидов, соединений с водородом, гидроксидов. Их свойства как простых веществ, так и в соединениях сходны.
Периоды бывают малыми и большими. В малых — небольшое число элементов. К ним относятся первый (состоит из 2-х представителей), второй, а также третий (8 элементов).
Прочие периоды: 4-ый и 5-тый (по 18 элементов), 6-той (32), 7-мой (24) — называются большими.
Малые периоды включают элементы только главных подгрупп (А), большие периоды — элементы как главных, так и побочных подгрупп (Б).
В пределах одного периода наблюдается изменение различных характеристик атомов элементов (атомного радиуса, энергии ионизации, электроотрицательности и пр.). Так, слева направо радиус атома уменьшается, а энергия ионизации сродство к электрону, электроотрицательность возрастают. Происходит это в силу того, что в периоде для каждого следующего элемента увеличивается число электронов на внешнем слое и заряд ядра, что приводит к усилению связи электронов внешнего слоя с ядром и к сжатию атома.
Самый первый вариант таблицы Д.И. Менделеев представил в 1869 году, сегодняшний вариант датируется 1871-м годом. В настоящее время существует более 700 различных видов таблицы элементов (периодической системы), основными из которых являются три: краткий, длинный, сверхдлинный. Сверхдлинный вариант содержит выстроенные в таблицу ряды лантаноидов и актиноидов, т.е. включает дополнительные 14 групп, каждая по два элемента. В длинной форме таблицы ряды лантаноидов и актиноидов вынесены за пределы таблицы в виде двух дополнительных строк, которые обычно помещают под таблицей. Короткая форма, помимо вынесения лантаноидов и актиноидов, позволяет расположить четвертый и следующие за ним периоды в 2 строчки (в одной строке располагаются элементы главных подгрупп, во второй — побочных).
«Короткий» вариант:
«Сверхдлинный вартиан» характеризуется тем, что для каждого периода отведена ровно одна строка:
«Длинный» вариант отличается вынесением лантаноидов и актиноидов на отдельное от общей таблицы место.
История открытия Периодического закона.
К середине XIX века были открыты 63 химических элемента, и попытки найти закономерности в этом наборе предпринимались неоднократно.
В 1829 году Дёберейнер опубликовал найденный им «закон триад»: атомный вес многих элементов близок к среднему арифметическому двух других элементов, близких к исходному по химическим свойствам (стронций, кальций и барий; хлор, бром и йод и др.). Первую попытку расположить элементы в порядке возрастания атомных весов предпринял Александр Эмиль Шанкуртуа (1862), который разместил элементы вдоль винтовой линии и отметил частое циклическое повторение химических свойств по вертикали. Обе указанные модели не привлекли внимания научной общественности.
В 1866 году свой вариант периодической системы предложил химик и музыкант Джон Александр Ньюлендс, модель которого («закон октав») внешне немного напоминала менделеевскую, но была скомпрометирована настойчивыми попытками автора найти в таблице мистическую музыкальную гармонию. В этом же десятилетии появились ещё несколько попыток систематизации химических элементов; ближе всего к окончательному варианту подошёл Юлиус Лотар Мейер (1864). Д. И. Менделеев опубликовал свою первую схему периодической таблицы в 1869 году в статье «Соотношение свойств с атомным весом элементов» (в журнале Русского химического общества); ещё ранее (февраль 1869 г.) научное извещение об открытии было им разослано ведущим химикам мира.
По легенде, мысль о системе химических элементов пришла к Менделееву во сне, однако известно, что однажды на вопрос, как он открыл периодическую систему, учёный ответил: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово».
Написав на карточках основные свойства каждого элемента (их в то время было известно 63, из которых один — дидим Di — оказался в дальнейшем смесью двух вновь открытых элементов празеодима и неодима), Менделеев начинает многократно переставлять эти карточки, составлять из них ряды сходных по свойствам элементов, сопоставлять ряды один с другим. Итогом работы стал отправленный в 1869 году в научные учреждения России и других стран первый вариант системы («Опыт системы элементов, основанной на их атомном весе и химическом сходстве»), в котором элементы были расставлены по девятнадцати горизонтальным рядам (рядам сходных элементов, ставших прообразами групп современной системы) и по шести вертикальным столбцам (прообразам будущих периодов). В 1870 году Менделеев в «Основах химии» публикует второй вариант системы («Естественную систему элементов»), имеющий более привычный нам вид: горизонтальные столбцы элементов-аналогов превратились в восемь вертикально расположенных групп; шесть вертикальных столбцов первого варианта превратились в периоды, начинавшиеся щелочным металлом и заканчивающиеся галогеном. Каждый период был разбит на два ряда; элементы разных вошедших в группу рядов образовали подгруппы.
Сущность открытия Менделеева заключалась в том, что с ростом атомной массы химических элементов их свойства меняются не монотонно, а периодически. После определённого количества разных по свойствам элементов, расположенных по возрастанию атомного веса, свойства начинают повторяться. Например, натрий похож на калий, фтор похож на хлор, а золото похоже на серебро и медь. Разумеется, свойства не повторяются в точности, к ним добавляются и изменения. Отличием работы Менделеева от работ его предшественников было то, что основ для классификации элементов у Менделеева была не одна, а две — атомная масса и химическое сходство. Для того, чтобы периодичность полностью соблюдалась, Менделеевым были предприняты очень смелые шаги: он исправил атомные массы некоторых элементов (например, бериллия, индия, урана, тория, церия, титана, иттрия), несколько элементов разместил в своей системе вопреки принятым в то время представлениям об их сходстве с другими (например, таллий, считавшийся щелочным металлом, он поместил в третью группу согласно его фактической максимальной валентности), оставил в таблице пустые клетки, где должны были разместиться пока не открытые элементы. В 1871 году на основе этих работ Менделеев сформулировал Периодический закон, форма которого со временем была несколько усовершенствована.
Научная достоверность Периодического закона получила подтверждение очень скоро: в 1875—1886 годах были открыты галлий (экаалюминий), скандий (экабор) и германий (экасилиций), для которых Менделеев, пользуясь периодической системой, предсказал не только возможность их существования, но и, с поразительной точностью, целый ряд физических и химических свойств.
Как появлялись русские названия элементов?
Самые распространенные элементы, известные с глубокой древности, имеют русские корни. Это железо, золото, медь. Эти слова в русском языке появились задолго до того, как химия стала полноценной наукой.
Название водорода отчасти было заимствовано у Лавуазье, первооткрывателя этого элемента. Он показал, что из водорода (при добавлении кислорода) можно получить воду, и поэтому называл его «рождающим воду», или Hydrogenium. Поначалу при переводе работ француза русские ученые называли открытый им газ «водотворным веществом», а в 1824 г. Соловьев предложил современное название водород.
Всё тот же Лавуазье открыл ещё и кислород. Его он называл «порождающим кислоту», или Oxygenium. В русском языке газ некоторое время назывался «кислотворным веществом», пока в XIX в. не утвердилось современное название.
Схожее происхождение имеет и слово «углерод». Оно означает «рождающий уголь». Так как на латинский слово «уголь» переводится как carbo, то и международное название элемента звучит как Carboneum.
Сложнее история азота. Его русское название происходит от древнегреческого слова, переводящегося как «безжизненный». А вот его латинское название Nitrodenium означает «порождающий селитру».
Иногда происхождение имени элемента связано с минералом, из которого он получен. Например, бор назван в честь минерала бура, а бериллий – в честь берилла.
Латинское название лития Lithium происходит от древнегреческого слова «камень», а неона – от слова «новый».
Нередко вновь открытые элементы получали имена персонажей древнегреческой или иной мифологии. Например, гелий назван в честь бога Солнца Гелиоса, так как впервые его обнаружили в спектре нашей звезды, и лишь через несколько десятилетий гелий нашли и на Земле. Титан назван по имени титанов – родственников богов в древнегреческой мифологии. Название Ванадия происходит уже из скандинавских мифов – имя Ванадис в них носила богиня любви
«Химические элементы и их знаки»
Ключевые слова конспекта:Химические элементы, знаки химических элементов.
В химии очень важным является понятие «химический элемент» (слово «элемент» по-гречески означает «составная часть»). Чтобы понять его сущность, вспомните, чем различаются смеси и химические соединения.
Например, железо и сера свои свойства в смеси сохраняют. Поэтому можно утверждать, что смесь порошка железа с порошком серы состоит из двух простых веществ — железа и серы. Так как химическое соединение сульфид железа образуется из простых веществ — железа и серы, то хочется утверждать, что сульфид железа тоже состоит из железа и серы. Но познакомившись со свойствами сульфида железа, мы понимаем, что этого утверждать нельзя. Это сложное вещество, образовавшееся в результате химического взаимодействия, обладает совершенно другими свойствами, нежели исходные вещества. Потому что в состав сложных веществ входят не простые вещества, а атомы определённого вида.
ХИМИЧЕСКИЙ ЭЛЕМЕНТ — это определённый вид атомов.
Так, например, все атомы кислорода независимо от того, входят ли они в состав молекул кислорода или в состав молекул воды, — это химический элемент кислород. Все атомы водорода, железа, серы — это соответственно химические элементы водород, железо, сера и т. д.
В настоящее время известно 118 различных видов атомов, т. е. 118 химических элементов. Из атомов этого сравнительно небольшого числа элементов образуется огромное многообразие веществ. (Понятие «химический элемент» будет уточнено и расширено в дальнейших конспектах).
Пользуясь понятием «химический элемент», можно уточнить определения простых и сложных веществ: ПРОСТЫМИ называют вещества, которые состоят из атомов одного химического элемента. СЛОЖНЫМИ называют вещества, которые состоят из атомов разных химических элементов.
Следует различать понятия «простое вещество» и «химический элемент», хотя их названия в большинстве случаев совпадают. Поэтому каждый раз, когда мы встречаем слова «кислород», «водород», «железо», «сера» и т. д., нужно понимать, о чём идёт речь — о простом веществе или о химическом элементе. Если, например, говорят: «Растворённым в воде кислородом дышат рыбы», «Железо — это металл, который притягивается магнитом», это значит, что речь идёт о простых веществах — кислороде и железе. Если же говорят, что кислород или железо входит в состав какого-либо вещества, то имеют в виду кислород и железо как химические элементы.
Химические элементы и образуемые ими простые вещества можно разделить на две большие группы: металлы и неметаллы. Примерами металлов служат железо, алюминий, медь, золото, серебро и др. Металлы пластичны, имеют металлический блеск, хорошо проводят электрический ток. Примерами неметаллов служат сера, фосфор, водород, кислород, азот и др. Свойства неметаллов разнообразны.
Знаки химических элементов
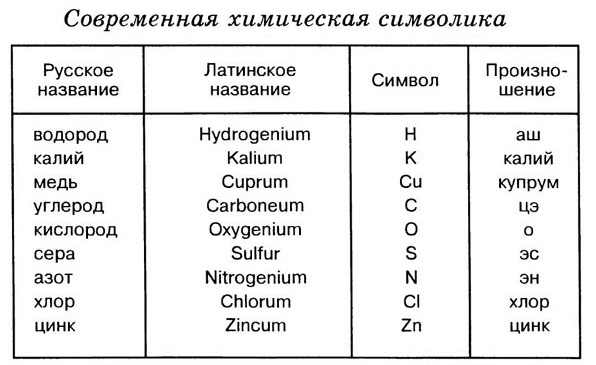
Каждый химический элемент имеет своё название. Для упрощённого обозначения химических элементов используют химическую символику. Химический элемент обозначают начальной или начальной и одной из последующих букв латинского названия данного элемента. Так, водород (лат. hydrogenium — гидрогениум) обозначают буквой Н, ртуть (лат. hydrargyrum — гидраргирум) — буквами Hg и т. д. Предложил современную химическую символику шведский химик Й. Я. Берцелиус в 1814 году
Сокращённые буквенные обозначения химических элементов — это знаки (или символы) химических элементов. Химический символ (химический знак) обозначает один атом данного химического элемента.
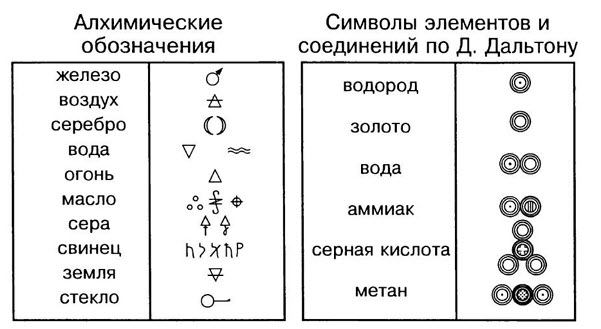
Конспект урока «Химические элементы и их знаки».
Следующая тема: «Относительная атомная масса».
Правила чтения английского языка для начинающих – таблица соответствия букв и звуков
Даже если вы начали изучать английский и его чтение с нуля, вам наверняка уже знакомо написание и звучание всех букв английского алфавита. Но, как мы уже усвоили из предыдущего раздела, при чтении произношение букв зависит от типа слога или буквенного сочетания. Поэтому, в приведенных ниже таблицах вы можете обнаружить сразу несколько вариантов звучания одной и той же буквы. Но не пугайтесь, для каждого случая будет приведено доступное объяснение. Итак, продолжим изучать английский для начинающих и узнавать правила чтения в английском языке.
Согласные буквы
Начнем с самого легкого: с таблицы согласных, произношение которых аналогично русскому звучанию.
| Буква | Транскрипция | Русское произношение |
| B | б | |
| D | д* | |
| F | ф | |
| K | к | |
| L | л | |
| M | м | |
| N | н | |
| P | п | |
| R | р | |
| S | с | |
| з (только в особых положениях: после звонких согласных, между двумя гласными и в суффиксе –ism.) | ||
| T | т* | |
| V | в | |
| W | в** | |
| Z | з |
*английские d и t произносятся с большим придыханием, чем русские аналоги.
**w произносится с вытянутыми в трубочку губами, в результате получается нечто среднее между русскими звуками в и у.
Теперь разберемся с более сложными буквами.
| Буква | Транскрипция | Произношение и пояснения |
| C | с (перед гласными i, e, y) | |
| к (в ост. случаях) | ||
| G | дж (перед гласными i, e, y) | |
| г (в ост. случаях) | ||
| H | Очень слабо произносимое русское Х (практически просто сильный выдох) | |
| Q | кв | |
| X | кс (перед согласным или в конце слова) | |
| гз (между двух гласных) | ||
| з (в начале слова перед гласной) |
А также изучим буквосочетания согласных в английском языке.
| Сочетание | Транскрипция | Произношение |
| ck | к | |
| ch | ч | |
| tch | ||
| ng | носовое н | |
| ph | ф | |
| sh | ш | |
| th | 1) звук средний между с и ф (язык между зубами)
2) звук средний между з и в (язык между зубами) |
|
| wr | р | |
| wh | у/в
х (только перед о) |
|
| qu | кв |
Ко всему прочему стоит учесть, что согласные, стоящие в самом конце слова, английский язык никогда не позволяет оглушать. Иначе, вы можете сказать совсем не то, что хотели. Например: back – сзади, позади; bag – сумка, мешок.
Гласные буквы
Намного сложнее справиться с чтением английских гласных, но нам помогут разобраться в нем уже знакомые правила открытых и закрытых слогов. Берем их на вооружение и учимся правильно читать гласные английского языка.
| Закрытый слог | |||
| Буква | Транскрипция | Произношение | Примеры |
| A | э | bat, track, sad | |
| E | э | pet, red, check | |
| I | и | pit, fill, tin, system, myth, lynx | |
| Y | |||
| O | о | spot, not, cross | |
| U | а | spun, truck, butter |
Не забывайте о том, что в закрытом слоге все буквы произносятся кратко.
| Открытый слог | |||
| Буква | Транскрипция | Произношение | Примеры |
| A | эй | game, flame, lake | |
| E | и | he, be, Pete | |
| I | ай | mine, like, nine, cry, bye, type | |
| Y | |||
| O | оу | bone, tone, rose | |
| U | ю | pupil, music, cube |
А гласные открытого слога всегда плавные и протяжные.
| Открытый слог с r | |||
| Буква | Транскрипция | Произношение | Примеры |
| A | эа | square | |
| E | иэ | here | |
| I | айэ | tired | |
| Y | |||
| O | оо | more | |
| U | юэ | cure |
Помним, что буква r после гласного, как правило, не произносится.
| Закрытый слог с r | |||
| Буква | Транскрипция | Произношение | Примеры |
| A | аа | dark | |
| O | оо | sport | |
| E | ё | pert, bird, myrtle, burn | |
| I | |||
| Y | |||
| U |
Теперь мы знаем, как надо читать гласные буквы в английских словах. Но для совершенного чтения по английскому языку необходимо изучить еще один момент.
Правила чтения в английском языке: таблица и карточки
Правила чтения в английском языке — это, скорее, даже не правила, а обобщенные рекомендации, не отличающиеся особой точностью. Мало того, что, скажем, буква «o» в разных сочетаниях и типах слога может читаться девятью разными способами, так еще и бывают исключения. К примеру, в словах food, too она читается как , а в словах good, look — как . Закономерности тут нет, это нужно просто запомнить.
Если поискать в разных книгах, окажется, что правила чтения, да и вообще фонетика, разными авторами могут рассказываться по-разному с разной степенью погружения в детали. Я думаю, что нет смысла углубляться в дебри фонетической науки (туда можно погружаться до бесконечности), а проще всего взять за основу наиболее упрощенный вариант правил чтения, то есть правила чтения в английском языке для детей.
Для этой статьи я взял за основу правила, приведенные в учебнике «Английский язык. 1 — 4 классы в схемах и таблицах» Н. Вакуленко. Поверьте, это более чем достаточно и для детей, и для взрослых!
Что такое открытый и закрытый слог?
В английском выделяют открытый слог и закрытый, также имеет значение заканчивается ли он на букву «r» и является ли ударным.
Слог называют открытым, если:
- слог заканчивается на гласную и является последним в слове,
- за гласным идет другой гласный,
- за гласным идет согласный, а за ним — один или более гласных.
Слог закрытый, если:
- он последний в слове, при этом заканчивается на согласный,
- после гласного стоят два или более согласных.
В этих карточках и таблице под ними вы можете увидеть, как произносятся разные буквы в разных сочетаниях и типах слога.
| Правила чтения | |
| Чтение буквы «A» | |
|---|---|
| A — в открытом слоге | name, face, cake |
| A — в закрытом слоге | hat, cat, man |
| A — в закрытом слоге на r | far, car, park |
| A — в конце слова гласный + re | dare, care, stare |
| A — сочетания all, au | all, wall, fall, autumn |
| Чтение буквы «О» | |
| O — в открытом слоге | no, go, home |
| O — в закрытом ударном слоге | not, box, hot |
| O — в некоторых словах с «wor» | world, word |
| O — в закрытом слоге на r | form, fork, horse, door, floor |
| O — в сочетании «oo» | too, food |
| O — в сочетании «oo» | book, look, good |
| O — в сочетании «ow» | town, down |
| O — в сочетании «oy» | toy, boy, enjoy |
| O — в сочетании «oo» | poor |
| Чтение буквы «U» | |
| U , — в открытом слоге | pupil, blue, student |
| U — в закрытом слоге | nut, bus, cup |
| U — в закрытом слоге | put, full |
| U — в сочетании «ur» | turn, hurt, burn |
| Чтение буквы «E» | |
| E — в открытом слоге, сочетании «ee», «ea» | he, she, see, street, meat, sea |
| E — в закрытом слоге, сочетании «ea» | hen, ten, bed, head, bread |
| E — в сочетаниях «er», «ear» | her, heard |
| E — в сочетаниях «ear» | hear, near |
| Чтение буквы «I» | |
| i — в открытом слоге | five, line, night, light |
| i — в закрытом слоге | his, it, pig |
| i — в сочетании «ir» | first, girl, bird |
| i — в сочетании «ire» | fire, tired |
| Чтение буквы «Y» | |
| Y — в конце слова | try, my, cry |
| Y — в конце слова | family, happy, lucky |
| Y — в начале или середине слова | yes, year, yellow |
| Чтение буквы «C» | |
| C — перед i, e, y | pencil, bicycle |
| C — кроме сочетаний ch, tch и не перед i, e, y | cat, come |
| C — в сочетаниях ch, tch | chair, change, match, catch |
| Чтение буквы «S» | |
| S — кроме : в конце слов после гл. и звонких согл. | say, books, six |
| S — в конце слов после гл. и звонких согл. | days, beds |
| S — в сочетании sh | shop, ship |
| Чтение буквы «T» | |
| T — кроме сочетаний th | ten, teacher, today |
| T — в сочетании th | then, mother, there |
| T — в сочетании th | thin, sixth, thick |
| Чтение буквы «P» | |
| P — кроме сочетания ph | pen, penalty, powder |
| P — в сочетании ph | photo |
| Чтение буквы «G» | |
| G — кроме сочетаний ng, не перед e, i, y | go, big, dog |
| G — перед е, i, у | age, engineer |
| G — в сочетании ng в конце слова | sing, bring, king |
| G — в сочетании ng в середине слова | strongest |
Химическая номенклатура
Химическая номенклатура – правильное наименование химических веществ. Латинское слово nomenclatura переводится как «перечень имен, названий»
На ранней стадии развития химии веществам давались произвольные, случайные наименования (тривиальные названия). Легколетучие жидкости назывались спиртами, к ним относились «соляной спирт» – водный раствор соляной кислоты, «силитряный спирт» – азотная кислота, «нашатырный спирт» – водный раствор аммиака. Маслообразные жидкости и твердые вещества назывались маслами, например, концентрированная серная кислота носила название «купоросное масло», хлорид мышьяка – «мышьяковое масло».
Иногда вещества получали название по имени его первооткрывателя, например, «глауберова соль» Na2SO4 *10H2O, открытая немецким химиком И. Р. Глаубером в XVII веке.
 Рис. 2. Портрет И. Р. Глаубер.
Рис. 2. Портрет И. Р. Глаубер.
В старинных названиях могли указываться вкус веществ, цвет, запах, внешний вид, медицинское действие. Одно вещество иногда имело несколько наименований.
К концу XVIII века химикам было известно не более 150-200 соединений.
Первую систему научных названий в химии выработала в 1787 г. комиссия химиков во главе с А. Лавуазье. Химическая номенклатура Лавуазье послужила основой для создания национальных химических номенклатур. Для того, чтобы химики разных стран понимали друг друга, номенклатура должна быть единой. В настоящее время построение химических формул и названий неорганических веществ подчиняется системе номенклатурных правил, созданной комиссией Международного союза теоретической и прикладной химии (ИЮПАК). Каждое вещество изображается формулой, в соответствии с ней строится систематическое название соединения.
 Рис. 3. А. Лавуазье.
Рис. 3. А. Лавуазье.
Что мы узнали?
Все химические элементы имеют латинские корни. Латинские названия химических элементов являются общепринятыми. В русский язык они переносятся с помощью калькирования или перевода. однако некоторые слова имеют изначально русское значение, например, медь или железо. Химической номенклатуре подчиняются все химические вещества, состоящие из атомов и молекул. впервые система научных названий была разработана А. Лавуазье.
-
/10
Вопрос 1 из 10
Обозначение элементов
Каждый элемент в периодической системе Менделеева имеет несколько обозначений:
- название;
- буквенное выражение;
- атомный номер;
- массовое число.
Буквенное, название
В таблице может быть указано полное название вещества (например, Carbon), в таких случаях его располагают под химическим символом.
Символ — это сокращенное название элемента (например, гелий — He).
Иногда в таблице не указываются названия вещества и приводится лишь его химический символ. Обозначения, как правило, состоят из одной или двух латинских букв. Символ элемента расположен в центре соответствующей ячейки в таблице.
Атомный номер
Атомный номер элемента обычно располагается вверху соответствующей ячейки, посередине или в углу. Все элементы имеют атомные номера от 1 до 118. Атомный номер — это всегда целое число.
Массовое число
Массовое число — это общее количество протонов и нейтронов в ядре. Его легко определить по атомной массе элемента, округляя ее до ближайшего целого числа.
Атомная масса указывается внизу ячейки, под символом элемента. Атомная масса — это сумма масс частиц, которые составляют ядро атома (протоны и нейтроны), представляет собой среднюю величину, для большинства элементов записывается в виде десятичной дроби.
Например, фосфор (P) имеет атомную массу равную 30,97376, следовательно, массовое число (количество протонов и нейтронов в ядре) составит 31.
Валентность
Валентность — это свойство элементов образовывать химические связи.
Валентность бывает:
- постоянная;
- переменная (зависит от состава вещества, в которое входит элемент).
Определить валентность по таблице Менделеева несложно:
- Постоянная валентность идентична номеру группы главной подгруппы. Номера групп в таблице изображаются римскими цифрами.
- Переменная валентность (часто бывает у неметаллов) определяется по формуле: 8 (всего 8 групп в таблице) вычесть № группы, в которой находится вещество.
Например, вещества, находящиеся в первой группе главной подгруппы (Li, К) имеют валентность, равную I; элементы, которые располагаются во второй группе главной подгруппы (Mg, Ca) обладают II валентностью. Мышьяк (As) находится в V группе главной подгруппы, следовательно, значение его валентности также будет равняться V. Помимо этого, у вещества есть еще одно значение валентности. Определяется оно по приведенной выше формуле и равняется III.
Химические формулы сложных веществ
Формулу сложного вещества составляют путем записи знаков химических элементов, из которых это вещество состоит, с указанием числа атомов каждого элемента в молекуле. При этом, как правило, химические элементы записывают в порядке увеличения их электроотрицательности в соответствии со следующим практическим рядом:
Me, Si, B, Te, H, P, As, I, Se, C, S, Br, Cl, N, O, F
Например, H2O, CaSO4, Al2O3, CS2, OF2, NaH.
Исключение составляют:
·некоторые соединения азота с водородом (например, аммиакNH3, гидразинN2H4);
·соли органических кислот (например, формиат натрияHCOONa, ацетат кальция(CH3COO)2Ca);
·углеводороды (CH4, C2H4, C2H2).
Химические формулы веществ, существующих в виде димеров (NO2, P2O3, P2O5, соли одновалентной ртути, например: HgCl, HgNO3 и др.), записывают в виде N2O4, P4O6, P4O10, Hg2Cl2, Hg2(NO3)2.
Число атомов химического элемента в молекуле и сложном ионе определяется на основании понятия валентности или степени окисления и записывается индексом внизу справа от знака каждого элемента (индекс 1 опускается). При этом исходят из правила:
алгебраическая сумма степеней окисления всех атомов в молекуле должна быть равной нулю (молекулы электронейтральны), а в сложном ионе – заряду иона.
Например:
2Al3+ +3SO42- =Al2(SO4)3
Этим же правилом пользуются при определении степени окисления химического элемента по формуле вещества или сложного иона. Обычно это элемент, имеющий несколько степеней окисления. Степени окисления остальных элементов, образующих молекулу или ион должны быть известны.
Заряд сложного иона – это алгебраическая сумма степеней окисления всех атомов, образующих ион. Поэтому при определении степени окисления химического элемента в сложном ионе сам ион заключается в скобки, а его заряд выносится за скобки.
При составлении формул по валентности вещество представляют, как соединение, состоящее из двух частиц различного типа, валентности которых известны. Далее пользуются правилом:
в молекуле произведение валентности на число частиц одного типа должно быть равным произведению валентности на число частиц другого типа.
Например:
Цифра, стоящая перед формулой в уравнении реакции, называется коэффициентом. Она указывает либо число молекул, либо число молей вещества.
Коэффициент, стоящий перед химическим знаком, указывает число атомов данного химического элемента, а в случае, когда знак является формулой простого вещества, коэффициент указывает либо число атомов, либо число молей этого вещества.
Например:
·3Fe – три атома железа, 3 моль атомов железа,
·2H – два атома водорода, 2 моль атомов водорода,
·H2 – одна молекула водорода, 1 моль водорода.
Химические формулы многих веществ были определены опытным путем, поэтому их называют «эмпирическими».
|
Сведения |
На примере CaCO3 |
|
Название вещества |
Карбонат кальция |
|
Принадлежность элемента к определенному классу веществ |
Средняя (нормальная) соль |
|
1 молекула карбоната кальция |
|
|
Один моль вещества |
6,02 · 1023молекул CaCO3 |
|
Относительная молекулярная масса вещества (Мr) |
Мr(CaCO3) = Ar(Ca)+Ar(C) +3Ar(O)=100 |
|
Молярная масса вещества (M) |
М(CaCO3) = 100 г/моль |
|
Абсолютная молекулярная масса вещества (m) |
M(CaCO3) = Mr(CaCO3) · 1,66 · 10-24г = 1,66 · 10-22г |
|
Качественный состав (какие химические элементы образуют вещество) |
кальций, углерод, кислород |
|
Число атомов каждого элемента в одной молекуле вещества: |
молекула карбоната кальция состоит из 1 атома кальция, 1 атома углерода и 3 атомов кислорода. |
|
Число молей каждого элемента в 1 моле вещества: |
В 1 моль СаСО3(6,02 ·1023 молекулах) содержится 1 моль (6,02 ·1023 атомов) кальция, 1 моль (6,02 ·1023 атомов) углерода и 3 моль (3·6,02·1023 атомов) химического элемента кислорода) |
|
Масса каждого элемента в 1 моле вещества: |
1 моль карбоната кальция (100г) содержит химических элементов: 40г кальция, 12г углерода, 48г кислорода. |
|
Массовые доли химических элементов в веществе (состав вещества в процентах по массе): |
Состав карбоната кальция по массе: W(Ca) = (n(Ca)·Ar(Ca))/Mr(CaCO3) = (1·40)/100= 0,4 (40%) W(C) = (n(Ca) ·Ar(Ca))/Mr(CaCO3) = (1·12)/100= 0,12 (12%) W(О) = (n(Ca) ·Ar(Ca))/Mr(CaCO3) = (3·16)/100= 0,48 (48%) |
|
Для вещества с ионной структурой (соли, кислоты, основания) – формула вещества дает информацию о числе ионов каждого вида в молекуле, их количестве и массе ионов в 1 моль вещества: |
Молекула СаСО3 состоит из иона Са2+ и иона СО32- 1 моль (6,02·1023 молекул) СаСО3 содержит 1 моль ионов Са2+и 1 моль ионовСО32-; 1 моль (100г) карбоната кальция содержит 40г ионовСа2+ и 60г ионовСО32- |
|
Молярный объем вещества при нормальных условиях (только для газов) |


































