Правила определения степени окисления
Как узнать степень окисления? При работе с окислительно-восстановительными реакциями важно знать, что формальный заряд частицы всегда будет равен величине электрона, выраженного в числовом значении. Эта особенность связана с тем предположением, что электронные пары, образующие связь, всегда полностью смещаются в сторону более отрицательных частиц
Следует понимать, что речь идет об ионных связях, а в случае реакции при ковалентной связи электроны будут делиться поровну между одинаковыми частицами.
Окислительное число может иметь как положительные, так и отрицательные значения. Все дело в том, что в процессе реакции атом должен стать нейтральным, а для этого нужно либо присоединить к иону некое количество электронов, если он положительный, либо отнять их, если он отрицательный. Для обозначения данного понятия при записи формулы обычно прописывают над обозначением элемента арабскую цифру с соответствующим знаком. Например, или и т.д.
Следует знать, что формальный заряд металлов всегда будет положительным, а в большинстве случаев, чтобы определить его, можно воспользоваться таблицей Менделеева. Существует ряд особенностей, которые необходимо учитывать, чтобы определять показатели правильно.
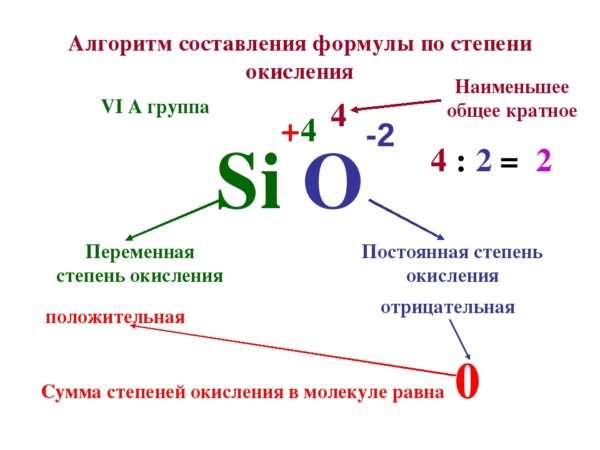 Как определить степень окисления
Как определить степень окисления
Степень оксидации:
- У простых элементов всегда равна нулю: или .
- У фтора всегда будет равна -1.
- Как и у металлов, у элементов из групп IA, IIA и IIIA групп всегда одинаковая – это номер группы, в которой они расположены.
- У кислорода в любой связи равна -2, кроме связей с пероксидами (Н2О2), когда значение равно -1 и оксидом фтора (O+2F2-1, O2+1F2-1), когда она равна +2.
- У водорода всегда +1, кроме его взаимодействия с гидридами (Na+H- и связями по типу C+4H4-1).
- У простого вещества без связей с другими элементами всегда равна нулю.
- У простого иона с одним атомом равна числу его электрона (Na+, Ca+2).
- Если рассматривается связь двух веществ различной природы (металл и неметалл), то отрицательное окислительное число будет наблюдаться у вещества, которое обладает большей электроотрицательностью (H+F-, Cu+Br-), а положительное, соответственно, у элемента с электроотрицательностью больше нуля.
- У щелочных металлов, таких как литий, натрий, калий и прочих, всегда +1.
- У металлов из главной подгруппы II (магний, барий, кальций и стронций) равна +2.
- У алюминия всегда одинаковое значение +3.
Запомнив эти особенности, достаточно просто будет определять окислительное число у элементов, независимо от сложности и количества уровней атомов.
Групповая электроотрицательность
В органической химии электроотрицательность больше связана с различными функциональными группами, чем с отдельными атомами. Термины групповая электроотрицательность и электроотрицательность заместителей используются как синонимы. Однако принято различать индукционный эффект и резонансный эффект , которые можно описать как σ- и π-электроотрицательности соответственно. Существует ряд линейных соотношений свободной энергии , которые использовались для количественной оценки этих эффектов, из которых уравнение Хаммета является наиболее известным. Параметры Кабачника — это групповые значения электроотрицательности для использования в химии фосфорорганических соединений .
Определение по формуле
Чтобы определить по формуле можно воспользоваться несколькими правилами:
- Если известна валентность (V) одного из эл-нтов в двойном соединении: допустим, есть соединение углерода и кислорода СО2, при этом мы знаем, что V кислорода всегда равна II, тогда для определения можем воспользоваться таким правилом: произведение числа атомов на его V одного эл-нта должно равняться произведению числа атомов другого эл-нта на его V. Таким образом, V углерода можно определить так – 2×2 (в молекуле 2 атома кислорода с V= 2), то есть она будет равняться 4. Рассмотрим еще несколько примеров, как определить валентность: P2O5 – тут V фосфора = (5*2)/2 = 5. HCl – V хлора будет равна I, так как в этой молекуле 1 атом водорода, и V= 1.
- Если известна V нескольких эл-нтов, которые составляют группу, определить можно так: в молекуле гидроксида натрия NaOH V кислорода равняется II, а V водорода – I, таким образом группа -OH обладает одной свободной валентностью, так как кислород присоединил только один атом водорода и еще одна связь свободна. К ней и присоединится натрий. Можно сделать вывод, что натрий – одновалентный элемент.
Общие сведения о валентности
Валентность – число ковалентных связей, которые может образовывать элемент в разных соединениях.
В отличии от степени окисления, понятие валентности есть реальный физический смысл.
Самый высокий показатель валентности равен номеру группы в таблице Менделеева. Сера S расположена в 6-ой группе, то есть ее максимальная валентность 6. Но она может быть также 2 (H2S) или 4 (SO2).
Почти для всех элементов характерна переменная валентность. Однако есть атомы, для которых эта величина постоянная. К ним относятся щелочные металлы, серебро, водород (их валентность всегда равна 1), цинк (валентность всегда 2), лантан (валентность равна 3).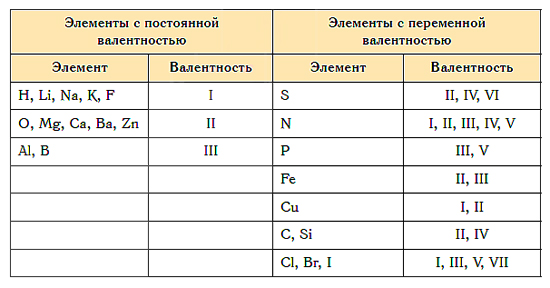
Степень окисления химических элементов
Ключевые слова конспекта: степень окисления химических элементов.
Атом в целом электронейтрален. Однако при образовании химических связей с атомами других элементов атом, как правило, приобретает частичный заряд. Например, при образовании ковалентной полярной связи между атомами водорода и хлора одноэлектронное s-облако атома водорода перекрывается одноэлектронным р-облаком атома хлора: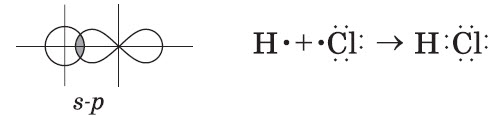
При этом общая электронная пара смещается в сторону более электроотрицательного атома хлора, но электрон атома водорода перейдет к атому хлора лишь частично, формируя тем самым частичные заряды атомов δ:
Если общую электронную пару в молекуле хлороводорода полностью «передать» атому хлора, то атом хлора «получит» назад собственный электрон и электрон от атома водорода, принимающий участие в ковалентной связи. Электрон атома водорода сформирует на атоме хлора отрицательный заряд, равный —1. А атом водорода, «потерявший» свой электрон, в этом случает приобретает заряд, равный +1. Эти заряды условны, их называют степенью окисления (СО).

Принято условно считать, что в соединениях с ковалентными полярными связями общие электронные пары полностью переходят к более электроотрицательному атому, а потому такие соединения состоят только из положительно и отрицательно заряженных ионов.
СО может иметь отрицательное, положительное или нулевое значения. Значения СО принято записывать сверху над символами элемента, при этом вначале указывается знак условного заряда, а затем его величина:
При определении СО элемента в химическом соединении необходимо учитывать, что:
- СО кислорода равна -2 (за исключением фторида кислорода и пероксидов, например );
- СО водорода равна +1 (за исключением гидридов, например );
- СО фтора во всех соединениях с другими элементами равна -1;
- СО металлов всегда положительна, максимальное значение СО металлов главных подгрупп обычно совпадает с номером группы, в которой расположен металл;
- СО свободных атомов и атомов, входящих в состав неполярных молекул (Н2, О2, Cl2 и т. д.), всегда равна нулю.
Правило электронейтральности вещества: Сумма степеней окисления всех атомов в соединении всегда равна нулю, а в сложном ионе — заряду иона.
При рассмотрении неорганических соединений, большинство из которых имеет ионное строение, обычно используют понятие степень окисления, а в органической химии, где большинство соединений имеют молекулярное строение, как правило, используют понятие валентность.
Пример
Пример. Определить СО марганца в соединении K2MnO4.
Пользуясь правилом электронейтральности вещества, составляем уравнение:
(+1) • 2 + х + (–2) • 4 = 0;
х = 8 – 2 = 6.
Таким образом, СО марганца +6:
В некоторых случаях значение степени окисления может не совпадать с валентностью. Так, в азоте N2 степень окисления азота равна 0, а его валентность равна 3. В пероксиде водорода 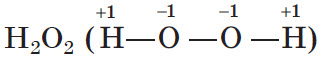 степень окисления кислорода равна -1, а его валентность равна 2.
степень окисления кислорода равна -1, а его валентность равна 2.

Конспект урока «Степень окисления химических элементов».
Темы, связанные с настоящим конспектом:
- Окислительно-восстановительные реакции
- Метод электронного баланса
- Окислители и восстановители
Электроотрицательность. Степень окисления и валентность химических элементов

Электроотрицательность (ЭО) — это способность атомов притягивать электроны при связывании с другими атомами.
Электроотрицательность зависит от расстояния между ядром и валентными электронами, и от того, насколько валентная оболочка близка к завершенной. Чем меньше радиус атома и чем больше валентных электронов, тем выше его ЭО.
Фтор является самым электроотрицательным элементом. Во-первых, он имеет на валентной оболочке 7 электронов (до октета недостает всего 1-го электрона) и, во-вторых, эта валентная оболочка (…2s2 2p5) расположена близко к ядру.
Менее всего электроотрицательны атомы щелочных и щелочноземельных металлов. Они имеют большие радиусы и их внешние электронные оболочки далеки от завершения. Им гораздо проще отдать свои валентные электроны другому атому (тогда предвнешняя оболочка станет завершенной), чем «добирать» электроны.
Электроотрицательность можно выразить количественно и выстроить элементы в ряд по ее возрастанию. Наиболее часто используют шкалу электроотрицательностей, предложенную американским химиком Л. Полингом.
Разность электроотрицательностей элементов в соединении (ΔX) позволит судить о типе химической связи. Если величина Δ X = 0 – связь ковалентная неполярная.
При разности электроотрицательностей до 2,0 связь называют ковалентной полярной, например: связь H—F в молекуле фтороводорода HF: Δ X = (3,98 — 2,20) = 1,78
Связи с разностью электроотрицательностей больше 2,0 считаются ионными. Например: связь Na—Cl в соединении NaCl: Δ X = (3,16 — 0,93) = 2,23.
Степень окисления
Степень окисления (СО) — это условный заряд атома в молекуле, вычисленный в предположении, что молекула состоит из ионов и в целом электронейтральна.
При образовании ионной связи происходит переход электрона от менее электроотрицательного атома к более электроотрицательному, атомы теряет свою электронейтральность, превращается в ионы. возникают целочисленные заряды.
При образовании ковалентной полярной связи электрон переходит не полностью, а частично, поэтому возникают частичные заряды (на рисунке ниже HCl).
Представим, что электрон перешел полностью от атома водорода к хлору, и на водороде возник целый положительный заряд +1, а на хлоре -1. такие условные заряды и называют степенью окисления.
У металлов главных подгрупп – одна характерная СО, у неметаллов, как правило, наблюдается разброс СО.
Поэтому неметаллы образуют большое количество соединений и обладают более «разнообразными» свойствами, по сравнению с металлами.
Примеры определения степени окисления
Определим степени окисления хлора в соединениях:
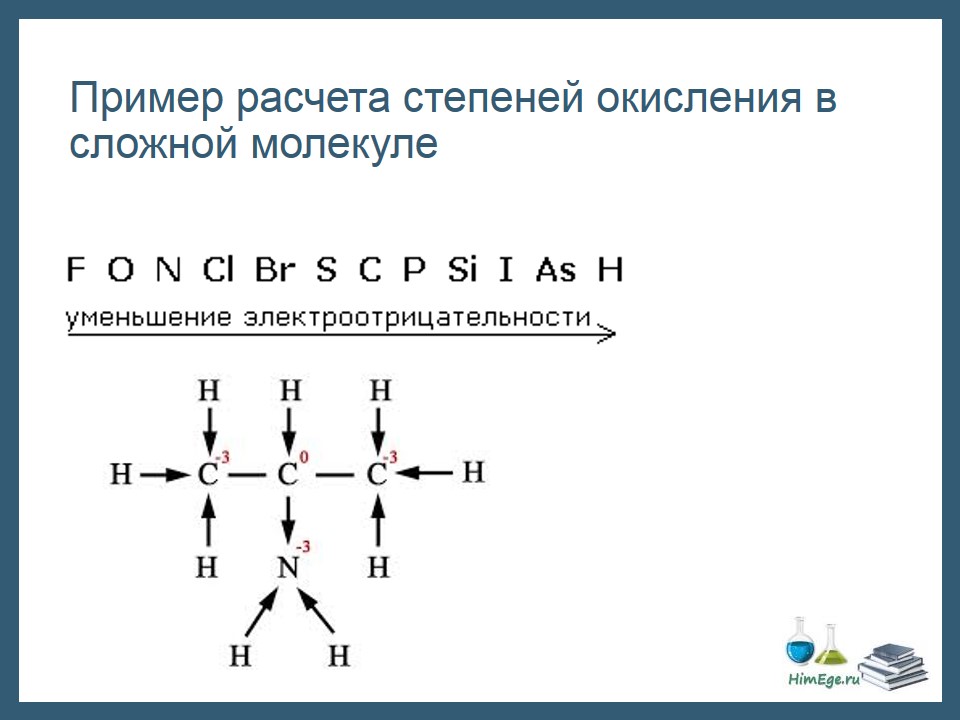
Те правила, которые мы рассмотрели не всегда позволяют рассчитать СО всех элементов, как например в данной молекуле аминопропана.
Здесь удобно пользоваться следующим приемом:
1)Изображаем структурную формулу молекулы, черточка – это связь, пара электронов.
2) Черточку превращаем в стрелку, направленную к более ЭО атому. Эта стрелка символизирует переход электрона к атому. Если связаны два одинаковых атома, оставляем черту как есть – нет перехода электронов.
3) Считаем сколько электронов «пришло» и «ушло».
Например, посчитаем заряд первого атома углерода. Три стрелки направленны к атому, значит, 3 электрона пришло, заряд -3.
Второй атом углерода: водород отдал ему электрон, а азот забрал один электрон. Заряд не поменялся, равен нулю. И т.д.
Валентность
Вале́нтность (от лат. valēns «имеющий силу») — способность атомов образовывать определённое число химических связей с атомами других элементов.
В основном, под валентностью понимается способность атомов к образованию определённого числа ковалентных связей. Если в атоме имеется n неспаренных электронов и m неподелённых электронных пар, то этот атом может образовывать n + m ковалентных связей с другими атомами, т.е.
его валентность будет равна n + m. При оценке максимальной валентности следует исходить из электронной конфигурации «возбуждённого» состояния.
Например, максимальная валентность атома бериллия, бора и азота равна 4 (например, в Be(OH)42-, BF4— и NH4+), фосфора — 5 (PCl5), серы — 6 (H2SO4), хлора — 7 (Cl2O7).
В азотной кислоте степень окисления азота равна +5, тогда как азот не может иметь валентность выше 4, т.к имеет только 4 орбитали на внешнем уровне (а связь можно рассматривать как перекрывание орбиталей). И вообще, любой элемент второго периода по этой же причине не может иметь валентность большую 4.
Ещё несколько «коварных» вопросов, в которых часто делают ошибки.
Примеры определения степени окисления
Определим степени окисления хлора в соединениях:

Те правила, которые мы рассмотрели не всегда позволяют рассчитать СО всех элементов, как например в данной молекуле аминопропана.
Здесь удобно пользоваться следующим приемом:
1)Изображаем структурную формулу молекулы, черточка – это связь, пара электронов.
2) Черточку превращаем в стрелку, направленную к более ЭО атому. Эта стрелка символизирует переход электрона к атому. Если связаны два одинаковых атома, оставляем черту как есть – нет перехода электронов.
3) Считаем сколько электронов «пришло» и «ушло».
Например, посчитаем заряд первого атома углерода. Три стрелки направленны к атому, значит, 3 электрона пришло, заряд -3.
Второй атом углерода: водород отдал ему электрон, а азот забрал один электрон. Заряд не поменялся, равен нулю. И т.д.
Шкалы электроотрицательности
Есть несколько определений электроотрицательности (Полинг, Малликен, Парр, Оллред и Рохоу), которые привели к построению нескольких шкал.
Определение Полинга : разница в электроотрицательности между элементами A и B имеет выражение
где , и — энергии связи двухатомных молекул AB, AA и BB. Коэффициент 0,102 поступает из блока , используемого для значений энергии (сначала в эВ) , который должен, в этой формуле, быть выражено в кДж моль -1 . Среднее значение энергий и часто является средним геометрическим (как здесь), но некоторые авторы используют среднее арифметическое.
EAB{\ displaystyle E _ {\ text {AB}}}EAA{\ displaystyle E _ {\ text {AA}}}EBB{\ displaystyle E _ {\ text {BB}}}EAA{\ displaystyle E _ {\ text {AA}}}EBB{\ displaystyle E _ {\ text {BB}}}
Это определение дает только разницу между двумя значениями электроотрицательности. Следовательно, нам нужно происхождение, которое было установлено произвольно, присвоив значение 4 электроотрицательности фтора (наиболее электроотрицательный элемент классификации).
Определение Малликена : электроотрицательность элемента — это произведение среднего значения его сродства к электрону A e и его энергии ионизации E I с альфа- коэффициентом = 0,317 эВ -1 :
Преимущество шкалы Малликена по сравнению со шкалой Полинга заключается в использовании размеров атомов независимо от химического окружения. Таким образом, это позволяет определить электроотрицательность благородных газов, чего Полинг сделать не смог.
Определение Оллреда и Рохоу: электроотрицательность элемента имеет для выражения
где — эффективный заряд ядра, элементарный заряд и ковалентный радиус элемента
Zежж{\ Displaystyle Z _ {\ mathrm {eff}}}е{\ displaystyle e}рпротивоv{\ Displaystyle г _ {\ mathrm {cov}}}
Определение Парра : электроотрицательность — это противоположность производной энергии атома по количеству электронов.
В наиболее широко используются электроотрицательность весов являются масштабом Mulliken , тем Allred-Рохи масштаб и масштаб Полинг .
Электроотрицательности атомов, участвующих в связи, имеют тенденцию быть равными (принцип уравнивания электроотрицательностей Сандерсона, 1951). Выравнивание электроотрицательностей достигается переносом электронной плотности на наиболее электроотрицательный атом.
Электроотрицательность используется для оценки ионного характера связи с использованием соотношения Полинга
или Хейни и Смит
Электроотрицательность — это также концепция полярности определенных молекул. Действительно, в молекуле , когда атомы по обе стороны от ковалентной связи имеют разную электроотрицательность, более электроотрицательный атом притягивает больше электронов. Следовательно, барицентр положительных зарядов не следует путать с барицентром отрицательных зарядов. Молекула остается нейтральной в глобальном масштабе, но внутри нее возникает электрическое поле , мы говорим, что связь поляризована или что молекула полярна.
Элементы с низкой электроотрицательностью часто называют электроположительными .
Причины постоянной и переменной валентности
Для большинства элементов характерно иметь переменную валентность. Но для некоторых она будет постоянной. Некоторые элементы Вам уже известны, пополнит этот список кислород и цинк, которые всегда двухвалентны, алюминий имеет число связей III.
Расположение элементов в периодической таблице подсказывает, о количестве связей, которые могут они образовать.
Определение валентности элементов по формулам
На рисунке изображены молекулы известных Вам веществ: это аммиак NH3, запах этого газа очень резкий и его трудно забыть, если хоть раз ощущали запах нашатырного спирта, с помощью его приводят людей в чувство после обморока.
С молекулой метана СН4 Вы встречаетесь на кухне, когда открываете газовый кран, чтобы приготовить пищу. На самом деле, метан не имеет запаха, но поскольку он относится к взрывоопасным веществам, то к нему прибавляют специальные соединения, имеющие запах, чтобы в случае утечки, его можно было обнаружить.
Молекула Н2О окружает нас повсюду. Во всех этих соединениях имеются атомы водорода, только в разных количествах. Давайте попробуем определить валентность по формуле вещества. Вспомним, что водород одновалентен. Если в аммиаке водорода насчитываем 3 атома, значит азот, условно, можем изобразить в виде такой детали.
Как видно с рисунка, он имеет валентность III. Поэтому принципу определим валентность углерода, приходим к выводу, что он четырёхвалентен.
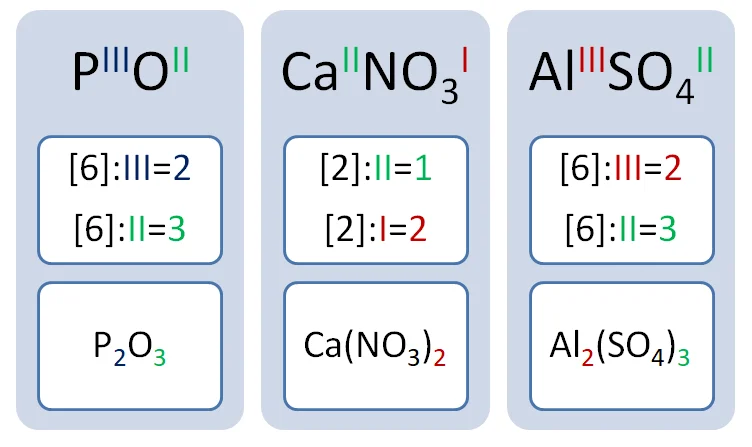
Но не всегда мы видим структурные формулы, которые отображают связи между атомами, и не всегда имеем дело с одновалентными элементами. Возьмём, к примеру, вещество состава Р2О5. На два атома фосфора приходится 5 атомов кислорода. Постоянную валентность имеет кислород, которая равняется II. Чтобы определить, какую валентность будет иметь фосфор, необходимо выполнить следующие математические действия.
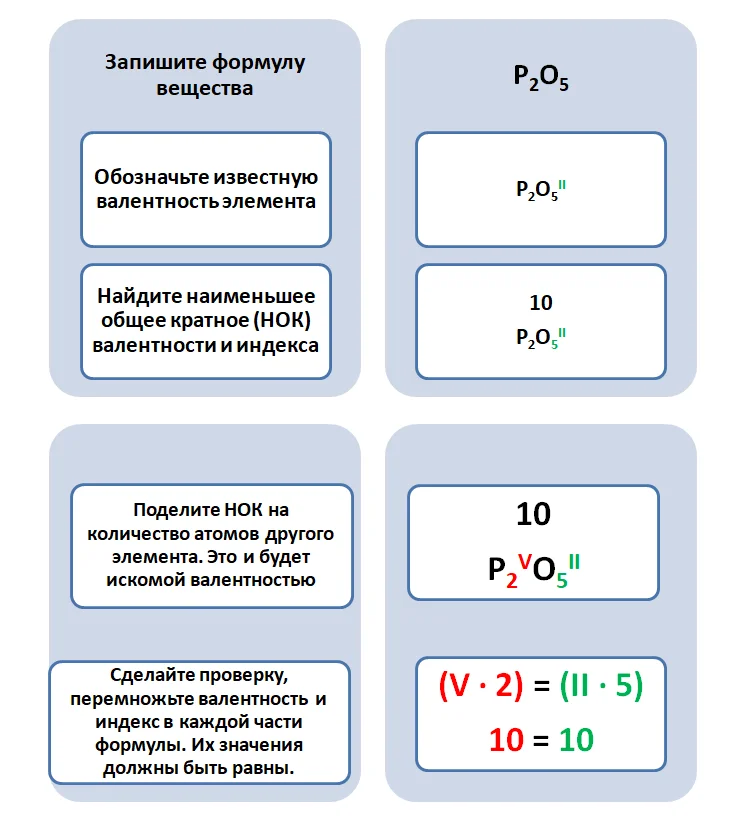
Встречаются такие соединения, где необходимо определить валентность остатков, входящих в состав кислот. Например, вещество состава Mg3(PO4)2.
Выполним согласно алгоритму. Магний всегда двухвалентен.

Искомая валентность кислотного остатка равна III. Следует заметить, что в веществе всегда находиться элемент, который проявляет постоянную валентность.
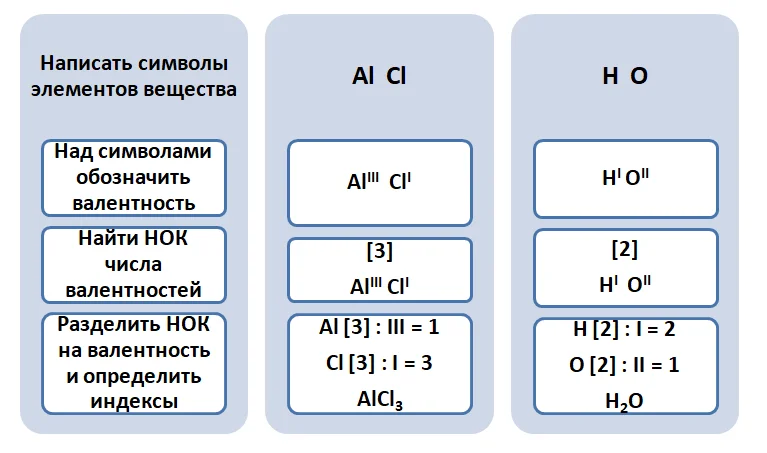
При написании уравнений реакций возникает необходимость составления формул веществ. Рассмотрим реакцию обмена между оксидом алюминия и соляной кислотой.
В результате обмена образуется два вещества состава AlCl и НО. Чтобы определить количественный состав в веществах, воспользуемся следующим алгоритмом.
Составление химических формул по валентности
Уравнение приобретает вид
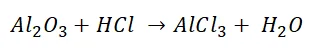
Обратите внимание, что количество атомов отличается в реагентах и продуктах, его необходимо уравнять
![]()
Составим формулы веществ по валентности элементов.
Немаловажную роль наравне с валентностью играет такое понятие как степень окисления (СО).
Термин валентность применим для соединений, имеющих молекулярное строение. Но, как известно, ещё существуют вещества ионного строения, которые образуются за счёт электростатического притяжения между разноимёнными зарядами. Каким образом они образуются? Чтобы ответить на данный вопрос, вспомним об электроотрицательности.
При образовании вещества, одни атомы будут отдавать свои электроны, другие – принимать. Рассмотрим на примере соединений молекулярного строения Cl2, HCl и ионного NaCl.
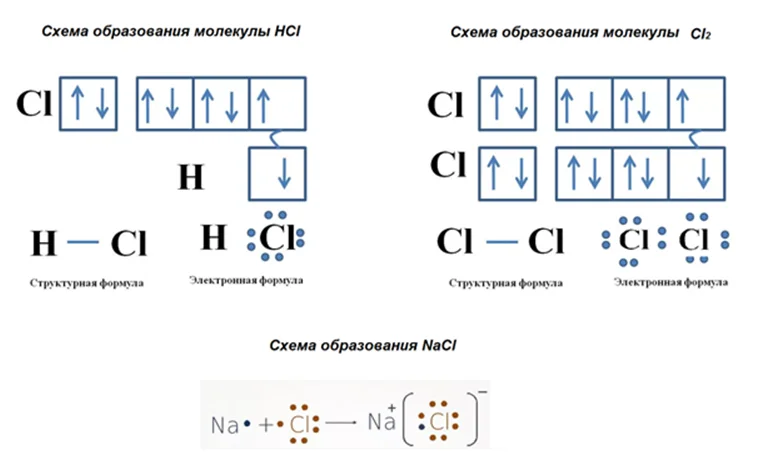
Обратите внимание, что вещества молекулярного строения, имеют структурную формулу, соединение атомов между собой показывается в виде черты – между ними. Для веществ имеющих строение, отличающее от молекулярного, более применимо понятие степени окисления, которое имеет универсальное применение для всех типов веществ
Каким образом получается молекула вещества HCl? У водорода имеется один-единственный электрон, который располагается на 1s уровне, у хлора целых 7, занимающих уровни 3s2 и 3р5. Как Вы считаете, какой атом будет отдавать, а какой принимать электроны? При всём своём желании, атом водорода никак не сможет принять электроны хлора, ему просто некуда. Как он сможет расположить в своей 1s ячейке целых 7 электронов хлора. Логично предположить, что принимать будет хлор. Ему как раз не хватает одного электрона, чтобы завершить свой уровень. Поэтому водород будет иметь заряд +, а хлор -. Степень окисления указывается в правом верхнем углу элемента, арабскими цифрами, знак + или – ставим перед цифрой H+Cl−.
А вот какую степень окисления имеет простое вещество. Атомы равноценные партнёры, поэтому она будет нулевая.
При образовании ионного соединения NaCl натрий, как элемент имеющий малое число электронов на внешнем слое, а именно 1, подобно водороду, отдаёт его хлору, образуя при этом катион Na+, хлор при этом становится отрицательным анионом Cl−.
Урок №66. Валентность и степень окисления. Правила определения степеней окисления элементов
I. Валентность
II. Степень окисления
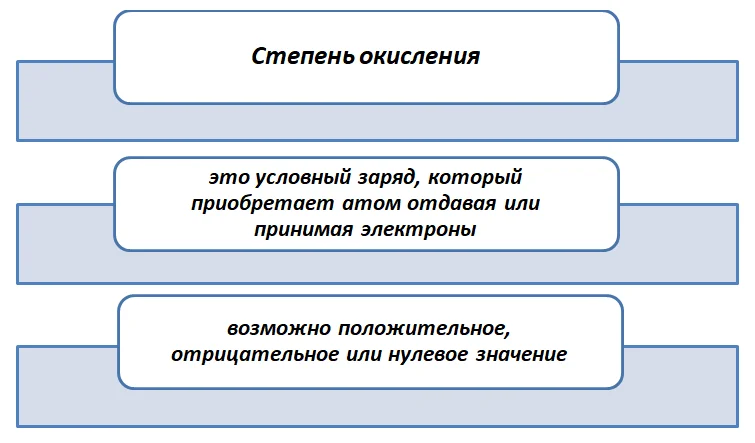
Степень окисления (СО) – это условный заряд, который получает атом в результате полной отдачи (принятия) электронов, исходя из условия, что все связи в соединении ионные.
Рассмотрим строение атомов фтора и натрия:
— Что можно сказать о завершённости внешнего уровня атомов фтора и натрия?
— Какому атому легче принять, а какому легче отдать валентные электроны с целью завершения внешнего уровня?
— Оба атома имеют незавершённый внешний уровень.
— Атому натрия легче отдавать электроны, фтору – принять электроны до завершения внешнего уровня.
Процесс отдачи электронов атомом, называется окислением .
Атом, отдающий электроны и повышающий свою степень окисления, окисляется и называется восстановителем .
Процесс принятия электронов атомом, называется восстановлением .
Атом, принимающий электроны и понижающий свою степень окисления, восстанавливается и называется окислителем .
Правила определения степени окисления атома
3. В сложных веществах степень окисления фтора -1
5. Элементы IA, IIA, IIIA групп отдают электроны и проявляют высшую «+» степень окисления, равную номеру группы
Э -ne — →Э +n
Э -ne — →Э +n
Э +ne — →Э -n
7. Элементы VIIIA группы (инертные или благородные газы) проявляют степень окисления равную
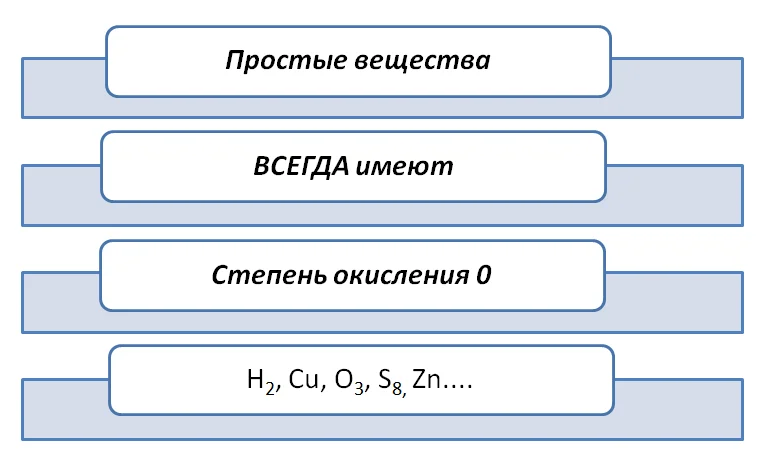
8. Степень окисления атомов в простых веществах равна
F 2 , S , O 3
9. В сложном веществе алгебраическая сумма СО всех атомов, с учётом их индексов, равна 0; а в сложном ионе его заряду.
H +1 N +5 O 3 -2 ((+1)*1)+((+5)*1)+((-2)*3)=0
(S +6 O 4 -2 ) -2 ((+6)*1)+((-2)*4)=-2
10. Металлы главных подгрупп IА-IIIА групп проявляют СО
+n = N группы
11. Металлы главных подгрупп групп IV-VII и металлы побочных подгрупп проявляют переменную степень окисления +n, согласно правилу №9 (с учётом рядом стоящего аниона – см. «Таблица растворимости веществ в воде»)
1. Проставим известные степени окисления у водорода и кислорода, а СО серы примем за «х»
2. Составим и решим уравнение, согласно правилу (II):
Х=6 или (+6), следовательно, у серы CО +6, т.е. S +6
1. Проставим известные степени окисления у водорода и кислорода, а СО фосфора примем за «х»
2. Составим и решим уравнение, согласно правилу (II):
Х=5 или (+5), следовательно, у фосфора CО +5, т.е. P +5
1. Проставим известную степень окисления у водорода, а СО азота примем за «х»
2. Составим и решим уравнение, согласно правилу (II):
Степень окисления
Степень окисления – условный заряд атома химического элемента в соединении, рассчитанный исходя из предположения, что все связи в его молекуле ионные, т.е. все связывающие электронные пары смещены к атомам с большей электроотрицательностью.
1) Степень окисления химических элементов в простых веществах всегда равна нулю.
2) Существуют элементы, проявляющие в сложных веществах постоянную степень окисления:
| Щелочные металлы, т.е. все металлы IA группы — Li, Na, K, Rb, Cs, Fr | +1 |
| Все элементы II группы, кроме ртути: Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd | +2 |
| Алюминий Al | +3 |
| Фтор F | -1 |
3) Существуют химические элементы, которые проявляют в подавляющем большинстве соединений постоянную степень окисления. К таким элементам относятся:
| водород H | +1 | Гидриды щелочных и щелочно-земельных металлов, например: |
| кислород O | -2 | Пероксиды водорода и металлов: Фторид кислорода — |
4) Алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю. Алгебраическая сумма степеней окисления всех атомов в ионе равна заряду иона.
5) Высшая (максимальная) степень окисления равна номеру группы. Исключения, которые не попадают под это правило, — элементы побочной подгруппы I группы, элементы побочной подгруппы VIII группы, а также кислород и фтор.
Химические элементы, номер группы которых не совпадает с их высшей степенью окисления (обязательные к запоминанию)
| Кислород | VI | +2 (в OF2) |
| Фтор | VII | |
| Медь | I | +2 |
| Железо | VIII | +6 (например K2FeO4) |
6) Низшая степень окисления металлов всегда равна нулю, а низшая степень окисления неметаллов рассчитывается по формуле:
низшая степень окисления неметалла = №группы − 8
Отталкиваясь от представленных выше правил, можно установить степень окисления химического элемента в любом веществе.
Решение:
Запишем формулу серной кислоты:
Степень окисления водорода во всех сложных веществах +1 (кроме гидридов металлов).
Степень окисления кислорода во всех сложных веществах равна -2 (кроме пероксидов и фторида кислорода OF2). Расставим известные степени окисления:
Обозначим степень окисления серы как x:
Молекула серной кислоты, как и молекула любого вещества, в целом электронейтральна, т.к. сумма степеней окисления всех атомов в молекуле равна нулю. Схематически это можно изобразить следующим образом:
Т.е. мы получили следующее уравнение:
Решим его:
Таким образом, степень окисления серы в серной кислоте равна +6.
Пример 2
Определите степень окисления всех элементов в дихромате аммония.
Решение:
Запишем формулу дихромата аммония:
Как и в предыдущем случае, мы можем расставить степени окисления водорода и кислорода:
Однако мы видим, что неизвестны степени окисления сразу у двух химических элементов — азота и хрома. Поэтому найти степени окисления аналогично предыдущему примеру мы не можем (одно уравнение с двумя переменными не имеет единственного решения).
Обратим внимание на то, что указанное вещество относится к классу солей и, соответственно, имеет ионное строение. Тогда справедливо можно сказать, что в состав дихромата аммония входят катионы NH4+ (заряд данного катиона можно посмотреть в таблице растворимости). Следовательно, так как в формульной единице дихромата аммония два положительных однозарядных катиона NH4+ , заряд дихромат-иона равен -2, поскольку вещество в целом электронейтрально. Т.е
вещество образовано катионами NH4+ и анионами Cr2O72-
Следовательно, так как в формульной единице дихромата аммония два положительных однозарядных катиона NH4+ , заряд дихромат-иона равен -2, поскольку вещество в целом электронейтрально. Т.е. вещество образовано катионами NH4+ и анионами Cr2O72-.
Мы знаем степени окисления водорода и кислорода. Зная, что сумма степеней окисления атомов всех элементов в ионе равна заряду, и обозначив степени окисления азота и хрома как x и y соответственно, мы можем записать:
Т.е. мы получаем два независимых уравнения:
Решая которые, находим x и y:
Таким образом, в дихромате аммония степени окисления азота -3, водорода +1, хрома +6, а кислорода -2.
Как определять степени окисления элементов в органических веществах можно почитать здесь.


































