Где происходит синтез, описание
Рибосомы, их функции
Рибосомы — одни из самых важных немембранных органелл, т.е. составных компонент живых клеток. Бывают эллипсоидной и сферической формы. Рибосомы — это рибонуклеопротеидный комплекс, который состоит из двух субъединиц: малой и большой. Они могут существовать как вместе, так и раздельно. Для начала синтеза белка субъединицы должны находиться отдельно.
Малая субъединица связывает мРНК в начале трансляции и находит стартовый кодон. Потом включается в работу большая, и целая рибосома производит биосинтез белка. Участок, который заведует образованием пептидной связи, находится в большой субъединице.
Рибосомы отвечают за считывание информации с матричной РНК и присоединение к пептидной цепочке белка соответствующей аминокислоты. Их синтез происходит в ядрышке, специальной внутриядерной структуре.
Рибосомы могут быть расположены по одиночке в цитоплазме, ни к чему не прикрепляясь, но чаще всего они находятся на мембранах эндоплазматической сети.
Эндоплазматическая сеть (ЭПС)
Она еще называется эндоплазматический ретикулум (ЭПР). Это внутриклеточный органоид клетки эукариота, который выглядит как разветвлённая сеть из окружённых мембраной уплощённых полостей, канальцев, карманов и пузырьков. ЭПС не стабильная структура, подвержена частым изменениям.
Мембраны ЭПС морфологически идентичны и составляют единое целое с клеточным ядром. Они обеспечивают активный транспорт, т.е. перемещение от меньшей концентрации к большей ряда элементов.
Трубочки ЭПС служат для связи между содержимым пузырьков, внешней средой и ядром.
Всего выделяют два вида эндоплазматического ретикулума:
- гранулярный (шероховатый);
- агранулярный (гладкий).
На поверхности гранулярного находится большое количество рибосом.
Функции ЭПС в биосинтезе белка — трансляция и транспорт.
Откуда начинается процесс
В большинстве случаев признаки начала биосинтеза — когда рибосома узнает стартовый AUG-кодон, кодирующий метионин. Иначе этот процесс называется инициация.
Транспортные РНК и аминоацил-тРНК-синтетазы
Транспортные РНК (тРНК) небольшие по размеру молекулы (73- 97 нуклеотидных остатков в цепи). Все тРНК имеют одинаковый 3′-конец, построенный из двух остатков цитозина и одного аденозина (CCA-конец). В середине цепи тРНК находится антикодон. В молекулах тРНК присутствет множество разнообразных модифицированных нуклеозидов (минорные нуклеозиды), образующиеся путем ферментативной модификации обычных нуклеозидных остатков.
Вторичная структура
Рисунок 6. Вторичная структура тРНК
Вторичная структура тРНК складывается за счет взаимокомплементарности участков цепи. Они формируют структуру «клеверного листа», состоящую из четырех стеблей и трех петель. Стебель с петлей формируют ветвь. В дополнение к трем петлям клеверного листа в структуре тРНК выделяют также дополнительную, или вариабельную, петлю (V петлю). Двухцепочечные стебли с постоянным числом спаренных нуклеотидов представляют собой двойную спираль.
Пространственная структура
Рисунок 7. Третичная структура тРНК
Третичная структура формируется за счет взаимодействия элементов вторичной структуры. Пространственная структура тРНК называется L-формой (из-за сходства с латинской буквой L).
Третичные взаимодействия (стекинг оснований и другие) скрепляют разные участки L-структуры в непрерывные двойные спирали.
Молекулам тРНК присущи индивидуальные различия, проявляющиеся на уровне вторичной и третичной структур, например, разная величина угла между доменами L-структуры.
Функции тРНК
Две основные функции тРНК:
- Акцепторная функция – способность ковалентно связываться с аминоацильным остатком, превращаясь в аминоацил-тРНК;
- Адапторная функция – способность узнавать триплет генетического кода, соответствующий транспортируемой аминокислоте, и обеспечивать поступление аминокислоты на «законное» место в растущей цепи белка.
Аминоацилирование тРНК
Аминоацилирование тРНК – процесс активации аминокислот. Он происходит на первом этапе биосинтеза белка – двадцать различных аминокислот присоединяются эфирной связью к соответствующим тРНК под действием двадцати различных активирующих ферментов, называемыми аминоацил-тРНК-синтетазами. Каждый фермент специфичен по отношению к определенной аминокислоте и к соответствующей тРНК.
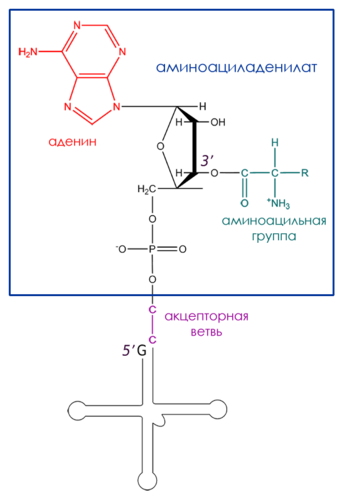
Рисунок 8. Обобщенная структура аминоацил-тРНК
Аминоацилирование состоит из двух стадий, проходящих в каталитическом центре фермента. На первой стадии в результате взаимодействия АТР и аминокислоты образуется промежуточное соединение – аминоациладенилат. На второй стадии аминоацильный остаток переносится с аминоациладенилата, связанного с ферментом, на соответствующую специфическую тРНК (Рисунок 8).
Аминоацилирование может быть выражено схемой:
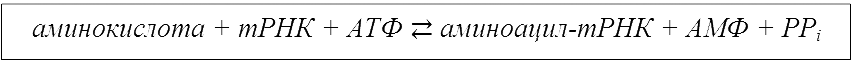
АТФ – аденозинтрифосфат, АМФ – аденозинмонофосфат, PPi – пирофосфаты.
Исключительно низкая частота ошибок при аминоацилировании тРНК является непременным условием реализации генетического кода – если на предрибосомном этапе произошла ошибка и к тРНК присоединилась аминокислота, не соответствующая специфичности антикодона, то эта ошибка уже не может быть исправлена на последующих этапах белкового синтеза.
В ходе эволюции выработались специфические механизмы отбора «правильных» субстратов для аминоацил-тРНК-синтетаз, обеспечивающие безошибочное аминоацилирование тРНК.
Узнавание тРНК аминоацил-тРНК-синтетазами
Каждая тРНК, сохраняя универсальную L-образную форму, имеет отличительные признаки, безошибочно распознаваемые «своим» ферментом как «притягательные», а остальными 19 ферментами – как «отталкивающие».
Это следующие участки тРНК (Рисунок 9):
- Антикодон
- Нуклеотид, предшествующий CCA-концу.
- Первые три пары нуклеотидов акцепторного стебля
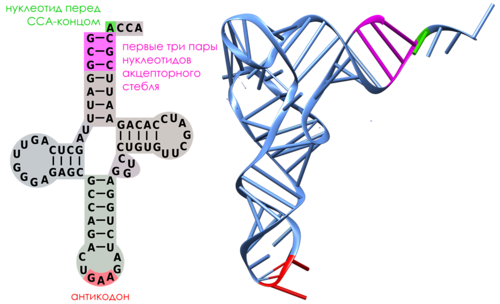
Рисунок 9. Участки, по которым происходит узнавание тРНК аминоацил-тРНК-синтетазами
Транскрипция и трансляция
Это два наиглавнейших шага биосинтеза.
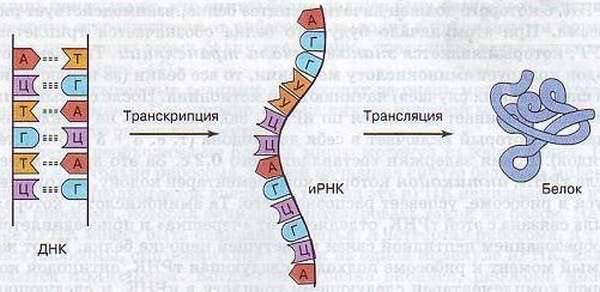
Транскрипция с латинского означает «переписывание» – в качестве матрицы применяется ДНК, поэтому происходит синтезирование трёх видов РНК (матричной/информационной, транспортной, рибосомной рибонуклеиновых кислот). Реакция осуществляется с помощью полимеразы (РНК) и с использованием большого количества аденозинтрифосфата.
Выделают два основных действия:
- Обозначение конца и начала трансляции присоединением иРНК.
- Событие, осуществляемое благодаря сплайсингу, который в свою очередь удаляет неинформационные последовательности РНК, тем самым происходит уменьшение массы матричной рибонуклеиновой кислоты в 10 раз.
Трансляция с латинского означает «перевод» – используется иРНК в качестве матрицы, синтезируются полипептидные цепочки.
Трансляция включает в себя три этапа, которые можно было представить в виде таблицы:
- Первый этап. Инициация формирование комплекса, который участвует в синтезе полипептидной цепочки.
- Второй этап. Элонгация увеличение размеров этой цепи.
- Третий этап. Терминация заключение выше упомянутого процесса.
Трансляция
Информация о структуре белка, записанная в и-РНК в виде последовательности нуклеотидов, переносится далее в виде последовательности аминокислот в синтезируемой полипептидной цепи. Этот процесс называют трансляцией. Для того чтобы разобраться в том, как в рибосомах происходит трансляция, т. е. перевод информации с языка нуклеиновых кислот на язык белков, обратимся к рисунку 3.
Рибосомы на рисунке изображены в виде яйцевидных тел, унизывающих и-РНК с левого конца и начинает синтез белка. По мере сборки белковой молекулы рибосома ползет по и-РНК. Когда рибосома продвинется вперед на 50-100 А, с того же конца на и-РНК входит вторая рибосома, которая, как и первая, начинает синтез и движется вслед за первой рибосомой. Затем на и-РНК вступает третья рибосома, четвертая и т. д. Все они выполняют одну и ту же работу: каждая синтезирует один и тот же белок, запрограммированный на данной и-РНК.
Чем дальше вправо продвинулась рибосома по и-РНК, тем больший отрезок белковой молекулы «собран». Когда рибосома достигает правого конца и-РНК, синтез окончен. Рибосома с образовавшимся белком сходит с и-РНК. Затем они расходятся: рибосома — на любую и-РНК (так как она способна к синтезу любого белка; характер белка зависит от матрицы), белковая молекула — в эндоплазматическую сеть и по ней перемещается в тот участок клетки, где требуется данный вид белка. Через короткое время заканчивает работу вторая рибосома, затем третья и т. д. А с левого конца и-РНК на нее вступают все новые и новые рибосомы, и синтез белка идет непрерывно. Число рибосом, умещающихся одновременно на молекуле и-РНК, зависит от длины и-РНК. Так, на молекуле и-РНК, которая программирует синтез белка гемоглобина и длина которой около 1500 А, помещается до пяти рибосом (диаметр рибосомы приблизительно равен 230 А). Группу рибосом, помещающуюся одновременно на одной молекуле и-РНК, называют полирибосомой.
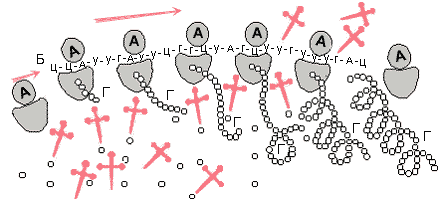
Рис. 3. Полирибосома: А — рибосома; Б — и-РНК; В — т-РНК с аминокислотами; Г — белок.
Теперь остановимся подробнее на механизме работы рибосомы. Обратимся к рисунку 4. Рибосома во время движения по и-РНК в каждый данный момент находится в контакте с небольшим учаством ее молекулы. Возможно, размер этого участка составляет всего один триплет нуклеотидов. Рибосома передвигается по и-РНК не плавно, а прерывисто, «шажками», триплет за триплетом. На некотором расстоянии от места контакта рибосомы с и-РЕК находится пункт «сборки» белка: здесь помещается и работает фермент белок-синтетаза, создающий полипептидную цепь, т. е. образующий пептидные связи между аминокислотами.
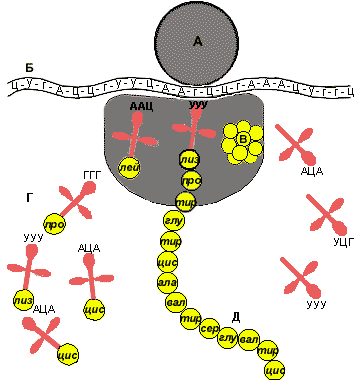
Рис. 4. Схема синтеза белка в рибосоме:
А — рибосома; Б — и-РНК; В — фермент (белок синтетаза); Г — т-РНК, несущие аминокислоты в рибосому; Д — белок.
Сам механизм «сборки» белковой молекулы в рибосомах осуществляется следующим образом. В каждую рибосому, входящую в состав полирибосомы, т. е. движущуюся по и-РНК, из окружающей среды непрерывным потоком идут молекулы т-РНК с «навешанными» на них аминокислотами. Они проходят, задевая своим кодовым концом место контакта рибосомы с и-РНК, который в данный момент находится в рибосоме. Противоположный конец т-РНК (несущий аминокислоту) оказывается при этом вблизи пункта «сборки» белка. Однако только в том случае, если кодовый триплет т-РНК окажется комплементарным к триплету и-РНК (находящемуся в данный момент в рибосоме), аминокислота, доставленная т-РНК, попадет в состав молекулы белка и отделится от т-РНК. Тотчас же рибосома делает «шаг» вперед по и-РНК на один триплет, а свободная т-РНК выбрасывается из рибосомы в окружающую среду. Здесь она захватывает новую молекулу аминокислоты и несет ее в любую из работающих рибосом. Так постепенно, триплет за триплетом, движется по и-РНК рибосома и растет звено за звеном — полипептидная цепь. Так работает рибосома — этот органоид клетки, который с полным правом называют «молекулярным автоматом» синтеза белка.
В лабораторных условиях искусственный синтез белка требует огромных усилий, много времени и средств. А в живой клетке синтез одной молекулы белка завершается в 1-2 мин.
Схема биосинтеза белка
По схеме видно, как протекает процесс.
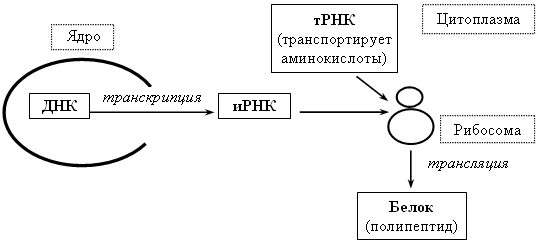
Точкой стыковки этой схемы являются рибосомы, в которых синтезируется белок. В простой форме синтез осуществляется по схеме
ДНК >, PHK >, белок.
Первым начинается этап транскрипции, в котором молекула изменяется в одноцепочную информационную рибонуклеиновую кислоту (иРНК). В ней содержится информация аминокислотной последовательности белка.
Следующей остановкой иРНК будет рибосома, в которой происходит сам синтез. Происходит это путём трансляции, формирования полипептидной цепочки. После этой заурядной схемы, полученный белок транспортируется в разные места, выполняя определённые задачи.
Транскрипция — первый этап биосинтеза белка
Транскрипция — это процесс синтеза молекулы иРНК на участке молекулы ДНК.
Транскрипция (с лат. transcription — переписывание) происходит в ядре клетки с участием ферментов, основную работу из которых осуществляет транскриптаза. В этом процессе матрицей является молекула ДНК.
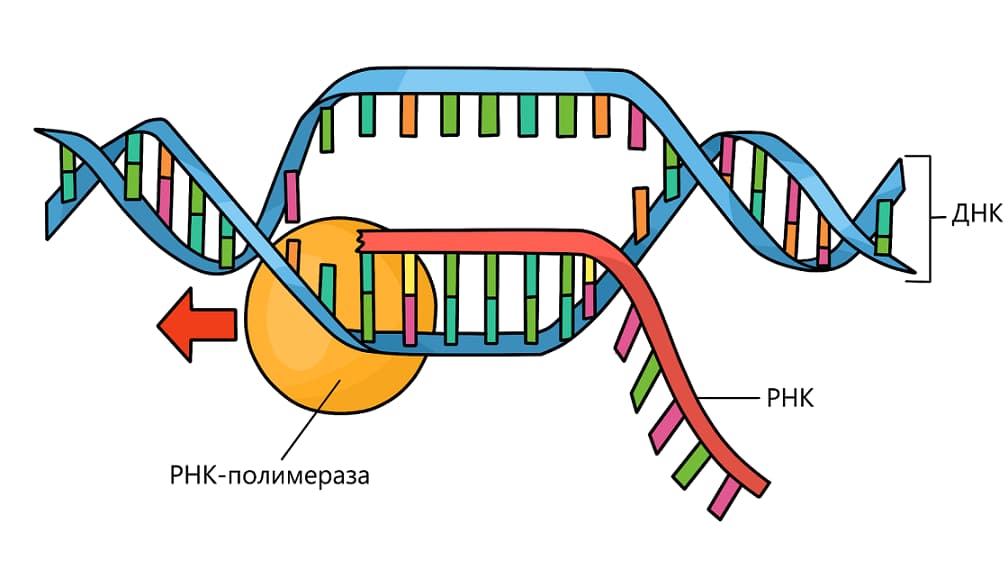
Специальный фермент находит ген и раскручивает участок двойной спирали ДНК. Фермент перемещается вдоль цепи ДНК и строит цепь информационной РНК в соответствии с принципом комплементарности. По мере движения фермента растущая цепь РНК матрицы отходит от молекулы, а двойная цепь ДНК восстанавливается. Когда фермент достигает конца копирования участка, то есть доходит до участка, называемого стоп-кодоном, молекула РНК отделяется от матрицы, то есть от молекулы ДНК. Таким образом, транскрипция — это первый этап биосинтеза белка. На этом этапе происходит считывание информации путём синтеза информационной РНК.
Копировать информацию, хотя она уже содержится в молекуле ДНК, необходимо по следующим причинам: синтез белка происходит в цитоплазме, а молекула ДНК слишком большая и не может пройти через ядерные поры в цитоплазму. А маленькая копия её участка — иРНК — может транспортироваться в цитоплазму.
После транскрипции громоздкая молекула ДНК остаётся в ядре, а молекула иРНК подвергается «созреванию» — происходит процессинг иРНК. На её 5’ конец подвешивается КЭП для защиты этого конца иРНК от РНКаз — ферментов, разрушающих молекулы РНК. На 3’ конце достраивается поли(А)-хвост, который также служит для защиты молекулы. После этого проходит сплайсинг — вырезание интронов (некодирующих участков) и сшивание экзонов (информационных участков). После процессинга подготовленная молекула транспортируется из ядра в цитоплазму через ядерные поры.
Транскрипция пошагово:
Проверьте себя: помните ли вы принцип комплементарности? Молекула ДНК состоит из двух спирально закрученных цепей. Цепи в молекуле ДНК противоположно направлены. Остов цепей ДНК образован сахарофосфатными остатками, а азотистые основания одной цепи располагаются в строго определённом порядке напротив азотистых оснований другой — это и есть правило комплементарности.
Понятие метаболизма
Метаболизм — совокупность всех химических реакций, протекающих в живом организме. Значение метаболизма состоит в создании необходимых организму веществ и обеспечении его энергией.
Выделяют две составные части метаболизма — катаболизм и анаболизм.
Составные части метаболизма
Часть
Характеристика
Примеры
Затраты энергии
Катаболизм (энергетический обмен, диссимиляция)
Совокупность химических реакций, приводящих к образованию простых веществ из более сложных
Гидролиз полимеров до мономеров и расщепление последних до низкомолекулярных соединений углекислого газа, воды, аммиака и других веществ
Энергия выделяется
Анаболизм (пластический обмен, ассимиляция)
Совокупность химических реакций синтеза сложных веществ из более простых
Образование углеводов из углекислого газа и воды в процессе фотосинтеза, реакции матричного синтеза
Энергия поглощается
Процессы пластического и энергетического обмена неразрывно связаны между собой. Все синтетические (анаболические) процессы нуждаются в энергии, поставляемой в ходе реакций диссимиляции. Сами же реакции расщепления (катаболизма) протекают лишь при участии ферментов, синтезируемых в процессе ассимиляции.
Роль ФТФ в метаболизме
Энергия, высвобождающаяся при распаде органических веществ, не сразу используется клеткой, а запасается в форме высокоэнергетических соединений, как правило, в форме аденозинтрифосфата (АТФ). По своей химической природе АТФ относится к мононуклеотидам.
АТФ (аденозинтрифосфорная кислота) — мононуклеотид, состоящий из аденина, рибозы и трёх остатков фосфорной кислоты, соединяющихся между собой макроэргическими связями.
В этих связях запасена энергия, которая высвобождается при их разрыве:
АТФ + H2O → АДФ + H3PO4 + Q1
АДФ + H2O → АМФ + H3PO4 + Q2
АМФ + H2O → аденин + рибоза + H3PO4 + Q3,
где АТФ — аденозинтрифосфорная кислота; АДФ — аденозиндифосфорная кислота; АМФ — аденозинмонофосфорная кислота; Q1 = Q2 = 30,6 кДж; Q3 = 13,8 кДж.
Запас АТФ в клетке ограничен и пополняется благодаря процессу фосфорилирования. Фосфорилирование — присоединение остатка фосфорной кислоты к АДФ (АДФ + Ф → АТФ). Он происходит с разной интенсивностью при дыхании, брожении и фотосинтезе. АТФ обновляется чрезвычайно быстро (у человека продолжительность жизни одной молекулы АТФ менее 1 мин).
Энергия, накопленная в молекулах АТФ, используется организмом в анаболических реакциях (реакциях биосинтеза). Молекула АТФ является универсальным хранителем и переносчиком энергии для всех живых существ.
Трансляция (синтез белка)
Трансляция (англ. translation – перевод) – это биосинтез белка на матрице мРНК.
После переноса информации с ДНК на матричную РНК начинается синтез белков. Каждая зрелая мРНК несет информацию только об одной полипептидной цепи. Если клетке необходимы другие белки, то необходимо транскрибировать мРНК с иных участков ДНК.
Биосинтез белков или трансляция происходит на рибосомах, внутриклеточных белоксинтезирующих органеллах, и включает 5 ключевых элементов:
- матрица – матричная РНК,
- растущая цепь – полипептид,
- субстрат для синтеза – 20 протеиногенных аминокислот,
- источник энергии – ГТФ,
- рибосомальные белки, рРНК и белковые факторы.
Выделяют три основных стадии трансляции: инициация, элонгация, терминация.
Инициация
Для инициации необходимы мРНК, ГТФ, малая и большая субъединицы рибосомы, три белковых фактора инициации (ИФ-1, ИФ-2, ИФ-3), метионин и тРНК для метионина.
В начале этой стадии формируются два тройных комплекса:
- первый комплекс – мРНК + малая субъединица + ИФ-3,
- второй комплекс – метионил-тРНК + ИФ-2 + ГТФ.
После формирования тройные комплексы объединяются с большой субъединицей рибосомы. В этом процессе активно участвуют белковые факторы инициации, источником энергии служит ГТФ. После сборки комплекса инициирующая метионил-тРНК связывается с первым кодоном АУГ матричной РНК и располагается в П-центре (пептидильный центр) большой субъединицы. А-центр (аминоацильный центр) остается свободным, он будет задействован на стадии элонгации для связывания аминоацил-тРНК.
События стадии инициации
После присоединения большой субъединицы начинается стадия элонгации.
Элонгация
Для этой стадии необходимы все 20 аминокислот, тРНК для всех аминокислот, белковые факторы элонгации, ГТФ. Удлинение цепи происходит со скоростью примерно 20 аминокислот в секунду.
Элонгация представляет собой циклический процесс. Первый цикл (и следующие циклы) элонгации включает три шага:
- Присоединение аминоацил-тРНК (еще второй) к кодону мРНК (еще второму), аминокислота при этом встраивается в А-центр рибосомы. Источником энергии служит ГТФ.
- Фермент пептидилтрансфераза осуществляет перенос метионина с метионил-тРНК (в П-центре) на вторую аминоацил-тРНК (в А-центре) с образованием пептидной связи между метионином и второй аминокислотой. При этом уже активированная СООН-группа метионина связывается со свободной NH2-группой второй аминокислоты. Здесь источником энергии служит макроэргическая связь между аминокислотой и тРНК.
- Фермент транслоказа перемещает мРНК относительно рибосомы таким образом, что первый кодон АУГ оказывается вне рибосомы, второй кодон (на рисунке ) становится напротив П-центра, напротив А-центра оказывается третий кодон (на рисунке ). Для этих процессов необходима затрата энергии ГТФ. Так как вместе с мРНК перемещаются закрепленные на ней тРНК, то инициирующая первая тРНК выходит из рибосомы, вторая тРНК с дипептидом помещается в П-центр.
Последовательность событий стадии элонгации
Второе повторение цикла – начинается с присоединения третьей аминоацил-тРНК к третьему кодону мРНК, аминокислота-3 становится в А-центр. Далее трансферазная реакции повторяется и образуется трипептид, занимающий А-центр, после чего он смещается в П-центр в транслоказной реакции..
В пустой А-центр входит четвертая аминоацил-тРНК и начинается третий цикл элонгации:
Образование пептидной связи при встраивании четвертой аминокислоты в пептид.Субъединицы рибосомы, большая часть транспортных РНК и матричная РНК не показаны.
Цикл элонгации (реакции 1,2,3) повторяется столько раз, сколько аминокислот необходимо включить в полипептидную цепь.
Терминация
Синтез белка продолжается до тех пор, пока рибосома не достигнет на мРНК особых терминирующих кодонов – стоп-кодонов УАА, УАГ, УГА. Данные триплеты не кодируют ни одной из аминокислот, их также называют нонсенс-кодоны. При вхождении этих кодонов внутрь рибосомы происходит активация белковых факторов терминации, которые последовательно катализируют:
- Гидролитическое отщепление полипептида от конечной тРНК.
- Отделение от П-центра последней, уже пустой, тРНК.
- Диссоциацию рибосомы.
Источником энергии для завершения трансляции является ГТФ.
Реакции стадии терминации
Полирибосомы
По причине того, что продолжительность жизни матричной РНК невелика, перед клеткой стоит задача использовать ее максимально эффективно, т.е. получить максимальное количество «белковых копий». Для достижения этой цели на каждой мРНК может располагаться не одна, а несколько рибосом, встающих последовательно друг за другом и синтезирующих пептидные цепи. Такие образования называются полирибосомы.
Трансляция
Трансляция – непосредственный процесс синтеза белка рибосомой. Трансляция проходит в три стадии: инициация, элонгация, терминация.
Стадия инициации
Трансляция у бактерий и в эукариотических клетках в общем схожи, но различаются механизмом инициации. Для инициация белкового синтеза в бактериях необходимы 30S и 50S рибосомные единицы, мРНК, молекула тРНК, аминоацилированная N-формилметионином – fMet-tRNAfMet, три белка, называемые факторами инициации, гуанозинтрифосфат (ГТФ), Mg2+. В процессе работы рибосома потребляет энергию гидролиза гуанозинтрифосфата (Рисунок 13).
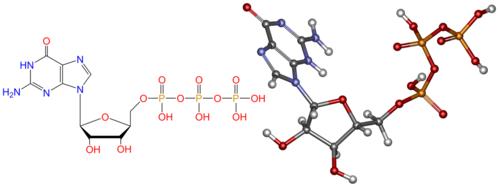
Рисунок 13. Структура гуанозинтрифосфата
Комплекс 30S субъединицы с факторами инициации распознает участки связывания рибосомы (сайты), которые содержат инициаторный кодон AUG, и специальную последовательность Шайна- Дальгарно, служащую для отличия AUG от внутренних кодонов, кодирующих метионин. В результате инициации образуется 70S рибосома – инициирующий комплекс, содержащий мРНК и fMet-tRNAfMet, связанную с P-участком рибосомы. Комплекс готов к элонгации.
В эукариотических клетках имеется как минимум девять факторов инициации. Инициирующий кодон AUG распознается не последовательностью Шайна-Дальгарно, а сканированием мРНК с 5′-конца до первого AUG и соответствующим расположением рамки считывания.
Стадия элонгации
Стадия элонгации требует комплекс инициации, аминоацил-тРНК, факторы элонгации (растворимые цитозольные белки) и гуанозинтрифосфат (ГТФ).
Синтез происходит на рибосоме путем последовательного добавления одного аминокислотного остатка за другим к строящейся полипептидной цепи; таким путем осуществляется элонгация (удлинение) пептида. Каждый новый аминокислотный остаток добавляется к карбоксильному концу (С-концу) пептида, т. е. С-конец пептида является растущим. Добавление одного аминокислотного остатка соответствует прочтению одного нуклеотидного триплета.
Элонгация проходит в три этапа, которые повторяются пока есть остатки аминокислот для присоединения.
На первом шаге аминоацил-тРНК молекула, нагруженная аминокислотой крепится к А-сайту рибосомы, а «отработавшая» тРНК высвобождается с Е-сайта (от exit — выход).
На втором шаге формируется новая пептидная связь под действием фермента пептидилтрансферазы.
На третьем шаге происходит транслокация: большая субъединица занимает позицию относительно малой субъединицы, оставляя две тРНК в гибридных сайтах: в Р-сайте на большой субъединице и А-сайте на малой для одной тРНК и в E-сайте на большой субъединице и Р-сайте на малой для другой. Затем малая субъединица перемещается вместе с мРНК на три нуклеотида, освобождая А-сайт для следующей тРНК и цикл повторяется снова. Молекула мРНК транслируется с 5′-конца к 3′-третьему, а синтез протеина начинается с N-конца. С началом каждого цикла аминокислота крепится к C-концу полипептидной цепи.
Стадия терминации
Элонгация продолжается до тех пор пока рибосома не присоединит последнюю аминокислоту. Терминация начинается при присутствии одного из трех терминаторных кодонов в мРНК (UAA, UAG, UGA), которые следуют сразу за последней аминокислотой. Когда рибосома достигнет терминирующего кодона мРНК, синтез полипептида прекращается. В бактериях, если терминаторный кодон имеет место быть в А-сайте рибосомы, в дело вступают три фактора терминации, которые участвуют в гидролизе пептидил-тРНК связи; освобождении полипептида и последней, уже ненагруженной тРНК из Р-сайта; диссоциации 70S рибосомы на 30S и 50S субъединицы, готовых начать новый цикл синтеза белка.
Таким образом, каждая рибосома проходит полный цикл трансляции, включающий инициацию, элонгацию и терминацию; в результате такого эпицикла прочитывается вся кодирующая последовательность мРНК и синтезируется законченная полипептидная цепь белка. После этого рибосома может повторить цикл с другой цепью мРНК или другой кодирующей последовательностью той же цепи.

































