Применение на приусадебном участке
Пригодится гидроксид натрия и в частном хозяйстве.
- Раствор поможет продезинфицировать теплицы, погреба, клетки и все помещения, где содержались сельскохозяйственные животные. Для этого следует растворить десять столовых ложек средства в десяти литрах горячей воды и тщательно промыть строения полученным раствором. Такая обработка избавит строения от грибка, паразитов, бактерий. Этим же средством можно вымыть полы в жилом помещении, чтобы не только очистить, но и продезинфицировать поверхность. Необходимо лишь после мытья содой хорошо промыть поверхность чистой водой и протереть насухо.
- Опрыскивание растений проводят раствором, состоящим из одной двух литров воды и одной ложки каустика. Опрыскивание приведёт к гибели долгоносика, тли и других вредных насекомых, поможет справиться с росой мучнистой и фитофторозом.
- Если в частном доме действует автономная система отопления, её можно с лёгкостью промыть каустиком. Для этого при помощи насоса систему заполняют двадцатипроцентным раствором натра и оставляют на два дня, затем сливают раствор вместе с грязью и промывают систему чистой водой.
Химические свойства
Бикарбонат натрия (NaHCO3) в быту известен как пищевая сода. Это растворимое белое соединение с легким щелочным вкусом. Встречается во многих минеральных источниках, производится искусственно.
При воздействии кислоты на бикарбонат получается углекислый газ и вода. Реакция следующая:
- NaHCO3 + HCl → NaCl + H2O + CO2 (газ);
- NaHCO3 + CH3COOH → NaCH3COO + H2O + CO2 (газ).
При нагреве 60 °С и более бикарбонат делится на:
- карбонат натрия;
- воду;
- углекислый газ.
А при температуре 200 °С он полностью разлагается на карбонат:
2NaHCO3 → Na2CO3 + H2O + CO2.
Гидроксид (NaOH), известный как щелок или каустическая сода, – это сильная химическая основа, востребованная не только для опытов, но и в промышленности. Может быть белым веществом в гранулах, хлопьях, и в виде 50-процентного насыщенного раствора. Гидроксид быстро забирает влагу и углекислоту из воздуха, поэтому его следует хранить в плотно закрытой таре.
Это вещество быстро растворяется в воде – процесс высвобождает тепло. Оно растворимо и в других полярных средах: этаноле, метаноле. Нерастворим в неполярных, например, в диэтиловом эфире.
Перчатки и средства защиты глаз следует обязательно носить во время работы с гидроксидом натрия, так как в случае, если он попадет на кожу, может появиться ожог. Если же вещество случайно попадет в глаз – высока вероятность частичной или полной утраты зрения.
Фартук из поливинилхлорида рекомендуется использовать при применении концентрированных растворов или твердой формы натрия. Его следует хранить вдали от сильных кислот, таких как серная кислота.

Каустическую соду получают электролизом хлорида натрия. Он собирается на катоде, после чего вода переходит в газообразный водород, гидроксидные ионы. Процесс, называемый «процессом хлоралканы», тоже производит хлор.
Гидроксид – ионное соединение натрий+гидроксид. В реакции с соляной кислотой получают хлорид натрия:
раствор NaOH(р-р) + HCl(р-р) → раствор NaCl(р-р) + H2O(ж).
Такие кислотно-основные реакции могут быть использованы для титрования, и это обычный способ измерения концентрации кислот. С этим связана реакция гидроксида с кислотными оксидами, такими как:
- диоксид углерода (CO2);
- диоксид серы (SO2).
Подобные реакции часто используются для «очистки» вредных кислых газов (таких как SO2 и H2S) и предотвращения их выброса в атмосферу.
Гидроксид медленно реагирует со стеклом с образованием силиката натрия, поэтому стеклянные соединения и запорные краны, подвергнутые воздействию NaOH, имеют тенденцию «замерзать». Лабораторные колбы и стеклянные химические реакторы повреждаются при длительном воздействии горячего гидроксида. Само стекло становится матовым.
Гидроксид не атакует железо или медь, но многие другие металлы, такие как алюминий, цинк и титан, вступают в реакцию быстро. По этой причине алюминиевые кастрюли никогда не следует чистить щелоком.
Свойства оснований
Щёлочи реагируют
1. С кислотными оксидами:
2КОН+SO3>K2SO4+H2O.
Щёлочи способны растворять оксидную плёнку алюминия (амфотерного оксида):
2. С кислотами:
NaOH+HCl>NaCl+HOH.
Можно определить, осталась ли щёлочь, если добавить 1-2 капли раствора фенолфталеина. Щёлочь прореагировала полностью, если малиновый цвет окрашивания раствора не появился.
Реакция между основанием и кислотой – реакция нейтрализации. Подобные реакции часто применяют с целью очищения сточных вод промышленных предприятий от щелочей и кислот. Продукты таких реакций – соли, которые более безопасны для окружающей среды. Очень эффективной и экономически выгодной является нейтрализация стоков различных производств.
3. С солями. Это реакции обмена. Происходят в растворе, при этом исходная соль должна быть водорастворимой. А получаемое вещество – нерастворимым:
2NaOH+Mn(NO3)2=Mn(OH)2v+2NaNO3
4. С галогенами.
На холоде: Cl2 + 2NaOH = NaClO+NaCl+H2O.
При нагревании: 3Cl2+6NaOH = NaClO3+5NaCl+3H2O.
Расплавить можно только гидроксиды натрия и калия (температуры плавления соединений составляют 322о и 405о соответственно).
Вопросы для самопроверки
-
Вспомните определение оснований и приведите 2 примера этих веществ.
-
Какие виды оснований существуют? Чем они отличаются?
-
К какому виду оснований относится Zn(OH)2?
-
Взаимодействуют ли основания с основными оксидами? Приведите примеры веществ, с которыми основания вступают в реакцию.
-
Можно ли получить гидроксид алюминия с помощью взаимодействия алюминия с водой?
Основания и другие темы по химии изучать интереснее, когда понимаешь, как применять знания в реальной жизни. На онлайн-курсах по химии в Skysmart преподаватели приводят яркие примеры: от процессов в природе до использования химических реакций в промышленности. Приходите учиться — вводный урок бесплатный!
Химические свойства
Щелочной металл на воздухе легко окисляется до оксида натрия. Для защиты от кислорода воздуха металлический натрий хранят под слоем керосина. При горении на воздухе или в кислороде образуется пероксид натрия. Кроме того, существует озонид натрия NaO3.С водой натрий реагирует очень бурно, помещённый в воду кусочек натрия всплывает, из-за выделяющегося тепла плавится, превращаясь в белый шарик, который быстро движется в разных направлениях по поверхности воды, реакция идёт с выделением водорода, который может воспламениться. Как и все щелочные металлы, натрий является сильным восстановителем и энергично взаимодействуют со многими неметаллами (за исключением азота, иода, углерода, благородных газов). Натрий более активен, чем литий. С азотом реагирует крайне плохо в тлеющем разряде, образуя очень неустойчивое вещество — нитрид натрия (в противоположность легко образующемуся нитриду лития): С разбавленными кислотами взаимодействует как обычный металл. С концентрированными окисляющими кислотами выделяются продукты восстановления. Растворяется в жидком аммиаке, образуя синий раствор. С газообразным аммиаком взаимодействует при нагревании. С ртутью образует амальгаму натрия, которая используется как более мягкий восстановитель вместо чистого металла. При сплавлении с калием даёт жидкий сплав. Алкилгалогениды с избытком металла могут давать натрийорганические соединения — высокоактивные соединения, которые обычно самовоспламеняются на воздухе и взрываются с водой. При недостатке металла происходит реакция Вюрца. Растворяется в краун-эфирах в присутствии органических растворителей, давая электрид или алкалид (в последнем у натрия необычная степень окисления −1).
Что такое гидроксид натрия
Это соединение – едкая щелочь, которая применяется не только пищевой, фармацевтической и косметической сферами, но и химической промышленностью. Гидроокись натрия, или каустическая сода, выпускается в виде немного скользких твердых гранул желтоватого или белого цвета. При сильной концентрации NaOH разъедает органические соединения, поэтому способен вызвать ожог. Используется как пищевая добавка Е524, необходимая для поддержания консистенции продуктов.
Формула
Вещество имеет химическую формулу NaOH. Соединение взаимодействует с различными веществами любых агрегатных состояний, нейтрализуя их, с кислотами, образуя соль и воду. Реакция с атмосферными оксидами и гидроксидами позволяет получить тетрагидроксоцинкат или алкоголят. Едкий натр применяется для осаждения металлов. Например, при реакции с сульфатом алюминия образуется его гидроксид. Осадок не растворяется и не наблюдается избыточное получение щелочи. Это актуально при очистке воды от мелких взвесей.
Свойства
Соединение растворяется в воде. Технический Sodium Hydroxide представляет собой водный раствор гидроксида натрия в щелочеустойчивой герметичной таре. При взаимодействии с водой каустик выделяет большое количество тепла. Вещество имеет следующие свойства:
- при предварительном расплавлении разрушает стекло, фарфор;
- взаимодействие с аммиаком вызывает пожароопасную ситуацию;
- кипит при 1390°С, плавится, если температура достигает 318°С;
- не растворяется в эфирах, ацетоне;
- очень гигроскопичен (поглощает пары воды из воздуха), поэтому натриевая щелочь должна храниться в сухом месте и герметичной упаковке;
- растворяется в метаноле, глицерине, этаноле;
- бурно взаимодействует с металлами – оловом, гидроксидом алюминия, свинцом, цинком, образует водород – взрывоопасный горючий яд;
- поглощает углекислый газ из воздуха.
- 5 бытовых аллергенов, которые живут прямо у вас под носом
- Пенсионный фонд ВТБ – как перевести накопления и их доходность, условия участия и описание программ
- Крем Циновит – инструкция по применению, состав, показания, побочные эффекты, аналоги и цена
Получение
Каустическая сода встречается в составе минерала брусита. Второе по величине месторождение сконцентрировано на территории России. Гидроокись благодаря исследованиям Николы Леблана, проведенным в 1787 г., получают методом синтеза из хлористого натрия. Позже востребованным способом добычи стал электролиз. С 1882 г. ученые разработали ферритный метод получения в лаборатории гидроксида с помощью кальцинированной соды. Электрохимический способ сейчас самый популярный: ионы натрия образуют его раствор едкой ртути – амальгаму, которая растворяется водой.
Литература
- Общая химическая технология. Под ред. И. П. Мухленова. Учебник для химико-технологических специальностей вузов. — М.: Высшая школа.
- Некрасов Б. В. Основы общей химии, т. 3. — М.: Химия, 1970.
- Фурмер И. Э., Зайцев В. Н. Общая химическая технология. — М.: Высшая школа, 1978.
- Приказ Минздрава РФ от 28 марта 2003 г. № 126 «Об утверждении Перечня вредных производственных факторов, при воздействии которых в профилактических целях рекомендуется употребление молока или других равноценных пищевых продуктов».
- Постановление Главного государственного санитарного врача РФ от 4 апреля 2003 г. № 32 «О введении в действие Санитарных правил по организации грузовых перевозок на железнодорожном транспорте. СП 2.5.1250-03».
- Федеральный закон от 21 июля 1997 г. № 116-ФЗ «О промышленной безопасности опасных производственных объектов» (с изм. на 18 декабря 2006 г.).
- Приказ МПР РФ от 2 декабря 2002 г. № 786 «Об утверждении федерального классификационного каталога отходов» (с изм. и доп. от 30 июля 2003 г.).
- Постановление Госкомтруда СССР от 25 октября 1974 г. № 298/П-22 «Об утверждении списка производств, цехов, профессий и должностей с вредными условиями труда, работа в которых даёт право на дополнительный отпуск и сокращённый рабочий день» (с изм. на 29 мая 1991 г.).
- Постановление Министерства труда России от 22 июля 1999 г. № 26 «Об утверждении типовых отраслевых норм бесплатной выдачи специальной одежды, специальной обуви и других средств индивидуальной защиты работникам химических производств».
- Постановление Главного государственного санитарного врача РФ от 30 мая 2003 г. № 116 О введении в действие ГН 2.1.6.1339-03 «Ориентировочные безопасные уровни воздействия (ОБУВ) загрязняющих веществ в атмосферном воздухе населённых мест».(с изм. на 3 ноября 2005 г.).
- Гурлев Д. С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988.
- Редько А. В. Основы фотографических процессов. — 2-е изд.. — СПб.: «Лань», 1999. — 512 с. — (Учебники для ВУЗов. Специальная литература). — 3000 экз. — ISBN 5-8114-0146-9.
Технологии изготовления
Исторический
В древности сода использовалась либо минерального, либо растительного происхождения. Сода, прототип минеральной щелочи , означает более или менее чистый карбонат натрия , который в первом случае произошел из озерных отложений на основе натрона , возможно, очищенного и высушенного, а во втором — из солей выщелачивания золы, полученной сгорания из галофитных растений , такие как солерос или Soudes . Затем каустической содой получали каустификацию (см. ).
Между 1771 и 1791 годами химик Николя Леблан изобрел процесс, позволяющий получать карбонат натрия из морской воды, процесс, требующий больших затрат топлива, который был вытеснен более экономичным процессом Сольвея между 1861 и 1864 годами (разработанный бельгийским предпринимателем и химиком Эрнестом Сольвеем ) . Эти процессы, особенно второй, позволяют снизить стоимость кальцинированной соды и отказаться от старых технологий.
В конце XIX — го века, появление электричества позволяет прямое производство гидроксида натрия путем электролиза водного раствора хлорида натрия , два отсеки электрода разделены мембраной , предотвращая миграцию газа , растворенного.
Таким образом, мы имеем следующие две полуреакции:
- растворенный хлорид-ион окисляется до газообразного хлора при контакте с анодом : 2 Cl — (сольватированный) → Cl 2 (газ) + 2 e — ;
- молекула воды , предварительно разложен на катоде в сольватированный протон или ион гидроксонии и гидроксид — ион , делает возможной , чтобы объяснить высвобождение водорода газа восстановления Н + протон и корреляционного подщелачиванием водной среды: 2 H 2 O(жидкий растворитель) + 2 e — → H 2 (газ) + 2 HO — (сольватированный)
или общая характеристика реакции электролиза соленой воды: 2 NaCl (водн.) + 2 H 2 O→ 2 NaOH (водн.) + Cl 2 (газ) + H 2 (газ)
Сегодня 99% производимой соды имеет электрохимическое происхождение.
Таблетки соды.
Электролиз рассола (вода, насыщенная солью)
Гидроксид натрия получают путем электролиза из хлорида натрия (NaCl).
В настоящее время соду в основном получают электролизом с ртутным катодом (анод: титан; катод: ртуть). Эта операция одновременно производит хлор , раствор гидроксида натрия и водород . Но ртуть является тяжелым металлом вредным биоаккумулирующей и при очень низких дозах, даже тогда , когда превращается в моно- или ди- метилртути пути бактерий . Он летуч и не разлагается, легко преодолевает барьер легких, что делает его одним из основных загрязнителей окружающей среды, количество которых увеличивается во всех морях. Это одна из причин, по которой участвующие европейские компании стремятся к 2020 году отказаться от этого процесса, заменив его мембранным электролизом .
Есть еще один процесс: диафрагменный электролиз , в котором используется асбест , который во Франции с конца 1990-х заменен композитным материалом.
Из карбоната натрия
Этот метод использовался в прошлом в Египте или Турции. Он до сих пор используется в Северной Америке, где есть естественные месторождения карбоната натрия . Это добавка извести к карбонату натрия. Мы говорим о каустификации или caustication . В реакции написано:
- Na 2 CO 3 (твердый) + Ca (OH) 2 (водный) → CaCO 3 + 2 NaOH (твердый после испарения воды из известкового молока)
Физические свойства
Металлический натрий, сохраняемый в минеральном масле
Качественное определение натрия с помощью пламени — ярко-жёлтый цвет эмиссионного спектра «D-линии натрия», дублет 588,9950 и 589,5924 нм. Натрий — серебристо-белый металл, в тонких слоях с фиолетовым оттенком, пластичен, даже мягок (легко режется ножом), свежий срез натрия блестит. Величины электропроводности и теплопроводности натрия достаточно высоки, плотность равна 0,96842 г/см³ (при 19,7 °C), температура плавления 97,86 °C, температура кипения 883,15 °C.
Под давлением становится прозрачным и красным, как рубин.
При комнатной температуре натрий образует кристаллы в кубической сингонии, пространственная группа I m3m, параметры ячейки a = 0,42820 нм, Z = 2.
При температуре −268 °С (5 К) натрий переходит в гексагональную фазу, пространственная группа P 63/mmc, параметры ячейки a = 0,3767 нм, c = 0,6154 нм, Z = 2.

Основные сферы применения
Биодизельное топливо
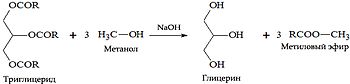
Получение биодизеля
Едкий натр применяется во множестве отраслей промышленности и для бытовых нужд:
Каустик применяется в целлюлозно-бумажной промышленности для делигнификации (сульфатный процесс) целлюлозы, в производстве бумаги, картона, искусственных волокон, древесно-волоконных плит.
Для омыления жиров при производстве мыла, шампуня и других моющих средств
В древности во время стирки в воду добавляли золу, и, по-видимому, хозяйки обратили внимание, что если зола содержит жир, попавший в очаг во время приготовления пищи, то посуда легко моется. О профессии мыловара (сапонариуса) впервые упоминает примерно в 385 году нашей эры Теодор Присцианус
Арабы варили мыло из масел и соды с VII века, сегодня мыла производятся тем же способом, что и 10 веков назад. В настоящее время продукты на основе гидроксида натрия (с добавлением гидроксида калия), нагретые до +50…+60 °C, применяются в сфере промышленной мойки для очистки изделий из нержавеющей стали от жира и других масляных веществ, а также остатков механической обработки.
В химических отраслях промышленности — для нейтрализации кислот и кислотных оксидов, как реагент или катализатор в химических реакциях, в химическом анализе для титрования, для травления алюминия и в производстве чистых металлов, в нефтепереработке — для производства масел.
Для изготовления биодизельного топлива — получаемого из растительных масел и используемого для замены обычного дизельного топлива. Для получения биодизеля к девяти массовым единицам растительного масла добавляется одна массовая единица спирта (то есть соблюдается соотношение 9:1), а также щелочной катализатор (NaOH). Полученный эфир (главным образом линолевой кислоты) отличается хорошей воспламеняемостью, обеспечиваемой высоким цетановым числом. Цетановое число — условная количественная характеристика самовоспламеняемости дизельных топлив в цилиндре двигателя (аналог октанового числа для бензинов). Если для минерального дизтоплива характерен показатель в 50-52 %, то метиловый эфир уже изначально соответствует 56-58 % цетана. Сырьём для производства биодизеля могут быть различные растительные масла: рапсовое, соевое и другие, кроме тех, в составе которых высокое содержание пальмитиновой кислоты (пальмовое масло). При его производстве в процессе этерификации также образуется глицерин, который используется в пищевой, косметической и бумажной промышленности, либо перерабатывается в эпихлоргидрин по методу Solvay.
В качестве агента для растворения засоров канализационных труб, в виде сухих гранул или в составе гелей (наряду с гидроксидом калия). Гидроксид натрия дезагрегирует засор и способствует лёгкому продвижению его далее по трубе.
В гражданской обороне для дегазации и нейтрализации отравляющих веществ, в том числе зарина, в ребризерах (изолирующих дыхательных аппаратах (ИДА), для очистки выдыхаемого воздуха от углекислого газа.
В текстильной промышленности — для мерсеризации хлопка и шерсти. При кратковременной обработке едким натром с последующей промывкой волокно приобретает прочность и шелковистый блеск.
Гидроксид натрия также используется для мойки пресс-форм автопокрышек.
В приготовлении пищи: для мытья и очистки фруктов и овощей от кожицы, в производстве шоколада и какао, напитков, мороженого, окрашивания карамели, для размягчения маслин и придания им чёрной окраски, при производстве хлебобулочных изделий. Зарегистрирован в качестве пищевой добавки E-524. Некоторые блюда готовятся с применением каустика:
лютефиск — скандинавское блюдо из рыбы — сушёная треска вымачивается 5-6 дней в едкой щёлочи и приобретает мягкую, желеобразную консистенцию.
брецель — немецкие крендели — перед выпечкой их обрабатывают в растворе едкой щёлочи, которая способствует образованию уникальной хрустящей корочки.
В косметологии для удаления ороговевших участков кожи, бородавок, папиллом.
В фотографии — как ускоряющее вещество в проявителях для высокоскоростной обработки фотографических материалов.
В чем может содержаться
Пищевая добавка Е524 может содержаться в самых разных группах продукции, в которых выполняет самые разные функции. Взять хотя бы джемы и мармелады, в составе которых часто содержится гидроксид натрия. В этой группе продуктов добавка играет роль регулятора и стабилизатора уровня кислотности. Если добавить некоторое количество едкого натра в тесто для выпечки, то готовая продукция получит красивую румяную хрустящую корочку.
Самая известная сдоба, приготовленная с использованием каустической соды – это немецкие рогалики. Черные консервированные оливки получают свой темный цвет и характерную консистенцию также благодаря добавке Е524. В изделиях из шоколада, какао, сливочного масла или других видов жиров гидроксид натрия ускоряет расщепление белков. Эта добавка приходит на помощь и тогда, когда необходимо быстро и без труда очистить плоды от кожицы. Для этого фрукты, ягоды или овощи просто обрабатывают каустической содой. Кроме того, регулятор кислотности Е524 используют в производстве кисломолочной продукции, маргаринов, мороженого, разных видов сладостей.
Гидроксид натрия – опасное химическое соединение
И хоть в пищевой промышленности Е524 используется в небольших дозах, которые обычно не представляют опасности для человека, излишняя осторожность не повредит. Если не желаете или не можете отказаться от Е-содержащей пищи сами, то постарайтесь хотя бы минимизировать количество «ешек» в рационе маленьких детей
А для этого не забывайте перед покупкой продукта проверять, из чего он состоит.
Больше свежей и актуальной информации о здоровье на нашем канале в Telegram. Подписывайтесь: https://t.me/foodandhealthru
Будем признательны, если воспользуетесь кнопочками:
Химический ожог щелочью
При использовании неразбавленных щелочей всегда стоит помнить, что они являются едкими веществами, которые при попадании на открытые участки тела вызывают покраснение, зуд, жжение, отек, в тяжелых случаях образуются пузыри. При длительном контакте такого опасного состава со слизистой органов зрения возможно наступление слепоты.
При химическом ожоге щелочью необходимо промыть пораженное место водой и очень слабым раствором кислоты — лимонной или уксусной. Даже незначительное количество едкой щелочи может вызвать обширное поражение кожи и ожог слизистых, поэтому с такими веществами стоит обращаться аккуратно и держать подальше от детей.
натрия гидроксид
Кристаллические модификации, структура молекулы, цвет растворов и паров:
До 299 С устойчива ромбическая модификация (a = 0,33994 нм, c = 1,1377 нм), выше 299 С — моноклинная. Энтальпия полиморфного перехода 5,85 кДж/моль.
Растворимость (в г/100 г растворителя или характеристика):
аммиак жидкийЛит.ацетонЛит.бензонитрилЛит.водаЛит.водаЛит.водаЛит.водаЛит.водаЛит.водаЛит.водаЛит.водаЛит.водаЛит.водаЛит.водаЛит.водаЛит.водаЛит.водаЛит.водаЛит.глицеринЛит.диэтиловый эфирЛит.метанолЛит.метилацетатЛит.этанолЛит.этилацетатЛит.
Фазовая и многокомпонентная растворимость (в масс%):
Лит.Лит.Лит.Лит.Лит.Лит.Лит.Лит.Лит.Лит.Лит.Лит.Лит.NaClЛит.NaClЛит.NaClЛит.NaClЛит.NaClЛит.Au(OH)3Лит.Au(OH)3Лит.Лит.Лит.Лит.
Способы получения:
-
Гидроксид натрия получают реакцией водного раствора карбоната натрия со взвесью гидроксида кальция в воде.
Na2CO3 + Ca(OH)2 → 2NaOH + CaCO3 -
Натрий энергично реагирует с водой при комнатной температуре с выделением водорода и образованием гидроксида натрия. При реакции с водой происходит расплавление натрия, при соприкосновении значительных количеств натрия и воды происходит взрыв. Реакция с водой начинается при температуре -98 °С.
2Na + 2H2O → 2NaOH + H2 - Гидроксид натрия получают электролизом водного раствора хлорида натрия с диафрагмой или колоколом.
- Гидроксид натрия получают электролизом водного раствора хлорида натрия с ртутным катодом с последующим разложением натриевой амальгамы водой.
Реакции вещества:
- Реагирует в водном растворе с соляной кислотой с образованием хлорида натрия и воды.
NaOH + HCl → NaCl + H2O
Реакции вещества:
-
Натрий растворяется в расплавленном гидроксиде натрия медленно и обратимо реагируя с ним с образованием оксида натрия и гидрида натрия. Выше 500 С протекает обратная реакция. Реакция с образованием водорода имеет лишь небольшой вклад в процесс.
2Na + NaOH → Na2O + NaH
Дополнительная информация::
Поглощает углекислый газ из воздуха превращаясь в карбонат. Водные растворы имеют сильнощелочную реакцию. Поглощает влагу из воздуха. В расплавленном виде разрушает стекло и фарфор, а при доступе кислорода — платину. Для плавления используют посуду из серебра, никеля или железа.
Источники информации:
- Comey A. M., Hahn D. A. A dictionary of Chemical Solubilities Inorganic. — 2 ed. — New York, The MacMillan Company, 1921. — С. 851-854
- Seidell A. Solubilities of inorganic and metal organic compounds. — 3ed., vol.1. — New York: D. Van Nostrand Company, 1940. — С. 1283-1286
- Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. — М.: Химия, 1981. — С. 303-304
- Лурье Ю.Ю. Справочник по аналитической химии. — М.: Химия, 1971. — С. 93
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. — Л.: Химия, 1977. — С. 84
- Справочник по растворимости. — Т.1, Кн.1. — М.-Л.: ИАН СССР, 1961. — С. 650-651
- Степин Б.Д., Цветков А.А. Неорганическая химия. — М.: Высшая школа, 1994. — С. 205
- Химическая энциклопедия. — Т. 3. — М.: Советская энциклопедия, 1992. — С. 181-182
- Написать вопрос на форум сайта (требуется зарегистрироваться на форуме). Там вам ответят или подскажут где вы ошиблись в запросе.
- Отправить пожелания для базы данных (анонимно).
Использование в домашнем хозяйстве
Несмотря на второй класс опасности, едкий натр можно применять в хозяйстве (при соблюдении соответствующих мер безопасности).
Чистка труб
Применение каустической соды для чистки канализации даёт очень хороший результат. Щёлочь поможет не только справиться с засором, но и удалить неприятные запахи в туалете и ванной комнате. Методы применения следующие:
- Половину стакана каустика засыпать в сливное отверстие, сверху аккуратно залить стакан кипятка и выдержать не менее двух часов. По истечении указанного времени промыть стоки большим количеством воды.
- Двести граммов соды засыпать в отверстие, добавить столько же белого уксуса, выдержать три часа, тщательно промыть кипятком. Этот метод промывки используется при сильных застарелых засорах.
- В ведро кипятка насыпать два килограмма каустика, перемешать, влить гидроксид натрия и воду непосредственно в отверстие слива. Через три часа прочистить трубы водой.
Важно: не следует насыпать соду непосредственно на эмалированную поверхность ванны, так эмаль может повредиться. https://www.youtube.com/embed/P6bjbBGRreo
Использование при стирке
Сода может применяться при стирке, она хорошо смягчает воду и удаляет различные пятна. пользуют раствор едкого натра только для стирки льняных и хлопчатобумажных вещей, стирка шёлка, шерсти и других тканей, требующих бережного отношения, не рекомендуется. Для приготовления раствора в пятилитровой ёмкости нужно развести пять столовых ложек соды, перемешать. Сухое бельё опускается в раствор, выдерживается в течение двух часов, после чего стирается порошком или мылом. При стирке в машинке две ложки средства добавляются в отсек для стирального порошка.
Сода может применяться при стирке, она хорошо смягчает воду и удаляет различные пятна
Сода может применяться при стирке, она хорошо смягчает воду и удаляет различные пятна.
для стирки льняных и хлопчатобумажных вещейСухое бельёстирается порошком или мылом
Важно: после использования каустической соды вещи необходимо тщательно прополоскать. https://www.youtube.com/embed/asuP1pkP2ho
Чистка кухонной утвари
Нагар и застаревший жир со стальной и чугунной посуды можно удалить с помощью щёлочи. Понадобятся следующие ингредиенты:
- Сода — 200 г.
- Вода — 10 литров.
- Клей силикатный или жидкое стекло — 150 мл.
- Мыло хозяйственное — один брусок.
Приготовление раствора: в ёмкость налить воду, добавить натр, клей или жидкое стекло, натёртое стиральное мыло, всё тщательно перемешать. Посуда опускается в моющий раствор, ёмкость ставится на огонь и кипятится на малом огне в течение двух часов, после чего нужно дождаться полного остывания. Очищенную посуду хорошо промыть под струёй проточной воды.
Важно: алюминий и тефлон мыть едким натром нельзя, для такой посуды используется кальцинированная соль. Разница между ними в том, что кальцинированная соль гораздо менее активна и не повредит посуде. Нагар и застаревший жир со стальной и чугунной посуды можно удалить с помощью щёлочи
Понадобятся следующие ингредиенты:
Нагар и застаревший жир со стальной и чугунной посуды можно удалить с помощью щёлочи. Понадобятся следующие ингредиенты:
- Сода — 200 г.
- Вода — 10 литров.
- Клей силикатный или жидкое стекло — 150 мл.
- Мыло хозяйственное — один брусок.
Приготовление раствора: в ёмкость налить воду, добавить натр, клей или жидкое стекло, натёртое стиральное мыло, всё тщательно перемешать. Посуда опускается в моющий раствор, ёмкость ставится на огонь и кипятится на малом огне в течение двух часов, после чего нужно дождаться полного остывания. Очищенную посуду хорошо промыть под струёй проточной воды.
Важно: алюминий и тефлон мыть едким натром нельзя, для такой посуды используется кальцинированная соль. Разница между ними в том, что кальцинированная соль гораздо менее активна и не повредит посуде
Примеры решения задач
ПРИМЕР 1
| Задание | Вычислите массу гидроксида натрия, который может прореагировать с концентрированным раствором соляной кислоты объемом 300 мл (массовая доля HCl 34%, плотность 1,168 кг/л). |
| Решение | Запишем уравнение реакции:
NaOH + HCl = NaCl + H 2 O. Найдем массу раствора соляной кислоты, а также массу растворенного вещества HCl в нем: m solution =V solution × ρ; m solution =0,3 × 1,168 = 0,3504 кг = 350,4г. ω = m solute / m solution × 100%; m solute = ω / 100% ×m solution ; m solute (HCl) = ω (HCl) / 100% ×m solution ; m solute (HCl) = 34 / 100% × 350,4= 11,91 г. Рассчитаем количество моль соляной кислоты (молярная масса равна 36,5 г/моль): n(HCl) = m (HCl) / M (HCl); n (HCl) = 11,91 / 36,5 = 0,34 моль. Согласно уравнению реакции n (HCl) :n (NaOH) =1: 1. Значит, n(NaOH) = n(HCl) = 0,34моль. Тогда масса гидроксида натрия, вступившего в реакцию будет равна (молярная масса — 40 г/моль): m (NaOH) = n (NaOH)× M (NaOH); m (NaOH) = 0,34× 40 = 13,6г. |
| Ответ | Масса гидроксида натрия равна 13,6 г. |
ПРИМЕР 2
| Задание | Вычислите массу карбоната натрия, который потребуется для получения гидроксида натрия по реакции взаимодействия с гидроксидом кальция массой 3,5 г. |
| Решение | Запишем уравнение реакции взаимодействия карбоната натрия с гидроксидом кальция с образованием гидроксида натрия:
Na 2 CO 3 + Ca(OH) 2 = CaCO 3 ↓ + 2NaOH. Рассчитаем количество вещества гидроксида кальция (молярная масса — 74 г/моль): n(Ca(OH) 2) = m (Ca(OH) 2) / M (Ca(OH) 2); n (Ca(OH) 2) = 3,5 / 74 = 0,05моль. Согласно уравнению реакции n(Ca(OH) 2) :n(Na 2 CO 3) = 1:1 . Тогда количество моль карбоната натрия будет равно: n (Na 2 CO 3) = n (Ca(OH) 2) = 0,05моль. Найдем массу карбоната натрия (молярная масса — 106 г/моль): m (Na 2 CO 3) = n (Na 2 CO 3) × M (Na 2 CO 3); m (Na 2 CO 3) = 0,05 × 106 = 5,3г. |
| Ответ | Масса карбоната натрия равна 5,3г. |
К
химическим методам получения гидроксида
натрия относятся известковый и ферритный.
Химические
методы получения гидроксида натрия
имеют существенные недостатки: расходуется
множество энергоносителей, получаемый
едкий натр сильно загрязнён примесями.
Сегодня
эти методы почти полностью вытеснены
электрохимическими методами производства.

































