Третий пример
Воспользовавшись методом электронного баланса, решите уравнение:
Cr2 (SO4) 3 +…+ NaOH = Na2CrO4 + NaBr +…+ H2O
В данной схеме пропущено два вещества, поэтому сначала восстановим пробелы. Хром в данном процессе меняет степень окисления с +3 на +6, следовательно, им проявляются окислительные характеристики. Восстановитель в задании упущен, поэтому его функцию будет выполнять молекулярный бром. Среди продуктов реакции должна быть соль натрия, ею будет сульфат.
Электронный баланс для данного превращения имеет вид:
2Cr(+3) — 6e = 2Cr(+6) 1
Br2(0) + 2e = 2Br — 3
При расстановке в схеме коэффициентов учитываем, что атом натрия находится в составе нескольких веществ, поэтому его необходимо суммировать:
Cr2(SO4) 3+3 Br2 + 16NaOH = 2Na2CrO4 + 6 NaBr + 3Na2 SO4 + 8H2O
- Cr2(SO4) 3 является окислителем;
- Br2 выступает в роли восстановителя.
Окислительно-восстановительная двойственность
Окислительно-восстановительная двойственность — это способность атома проявлять как свойства окислителя, так и свойства восстановителя в зависимости от условия протекания химической реакции.
Разберем вещества, атомы которых обладают окислительно-восстановительной двойственностью.
Сера
По отношению к водороду и металлам сера играет роль окислителя: S + H2 = H2S.
При взаимодействии с сильными окислителями повышает свою степень окисления до +4 или +6: S + KMnO4 = K2SO4 + MnO2.
Кислородсодержащие соединения серы в степени окисления +4
Сера в сульфитах и сернистой кислоте при взаимодействии с сильными окислителями повышает степень окисления до +6: SO2 + 2HNO3 (конц) = H2SO4 + 2NO2.
С восстановителями соединения серы проявляют окислительные свойства, восстанавливаясь до степени окисления 0 или −2: SO2 + C = CO2 + S.
Пероксид водорода
Атом кислорода в пероксиде водорода находится в промежуточной степени окисления –1, и в присутствии восстановителей может понижать степень окисления до –2: 4H2O2 + PbS = PbSO4 + 4H2O.
Атом кислорода в пероксиде водорода находится в промежуточной степени окисления –1, и в присутствии окислителей может повышать степень окисления до 0: 3H2O2 + 2KMnO4 = 3O2 + 2MnO2 + 2KOH + 2H2O.
Простое вещество йод
Окислительная способность проявляется у йода в реакции с такими восстановителями, как сероводород, фосфор и металлы: I2 + H2S = S + 2HI.
Йод при взаимодействии с более сильными окислителями играет роль восстановителя: I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl.
Азотистая кислота и нитриты
При взаимодействии с более сильными окислителями азот повышает степень окисления до +5 и превращается либо в азотную кислоту из азотистой, либо в нитрат-анион из нитрит-аниона: 5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O.
При взаимодействии с сильными восстановителями обычно происходит восстановление до NO (иногда до других соединений азота в более низких степенях окисления): 2HNO2 + 2HI = 2NO + I2 + 2H2O.
Для удобства мы собрали представителей типичных окислителей и восстановителей в одну схему.

Первый пример
Разве ОВР — химия? Как решать такие задания? Данный вопрос является актуальным для ребят, которые выбрали предмет в качестве выпускного экзамена. На примере взаимодействия оксида железа (3) и угарного газа (оксида углерода (2)) рассмотрим последовательность действий.

Итак, дана схема Fe2O3 + CO → Fe + CO2, ее нужно рассмотреть как ОВР. ЕГЭ (химия) в 11 классе предполагает самостоятельное дополнение школьниками схемы недостающими веществами, но мы начнем с более простого задания, в котором уже даны все участники процесса. Как проверить, что это ОВР? Химия отвечает на этот вопрос посредством степеней окисления. Так как железо превращается из +3 в простое вещество с нулевым показателем степени окисления, а углерод повышает ее с +2 до +4, процесс является ОВР.
Баланс данного задания имеет следующий вид:
Fe(+3)+3e=Fe(0) 2
C(+2)-2e=C(+4) 3
Наименьшее общее кратное составляет 6. Железо является окислителем, угарный газ проявляет восстановительную способность. В готовом виде процесс имеет вид:
Fe2O3 + 3CO → 2Fe + 3CO2
Примеры составления уравнений ОВР методом электронного баланса
1. Составить уравнение реакции алюминия с углеродом.
- Al+C → Al4C3
- В первую очередь, определяются элементы, меняющие свои степени окисления:
Al+C → Al4+3C3-4 - Атом алюминия в ходе реакции отдает 3 электрона, меняя свою степень окисления с 0 на +3
Al → Al+3
1Al-3e- → 1Al+3 - Атом углерода принимает 4 электрона, меняя свою степень окисления с 0 на -4
C → C+4
1C+4e- → 1C-4 - Поскольку, число отданных и принятых электронов между атомами должно совпадать, следует сбалансировать уравнение, подобрав множители, для этого кол-во отданных алюминием электронов, записывают в схему реакции углерода, а кол-во электронов, принятых углеродом — в схему реакции алюминия:
4| 1Al-3e- → 1Al+3 3| 1C+4e- → 1C-4
- В итоге, алюминий отдает 4·3=12 электронов;
- углерод принимает 3·4=12 электронов
- Осталось определить стехиометрические коэффициенты, которые необходимо проставить перед формулами веществ, чтобы уравнять кол-во их атомов в левой и правой части уравнения;
- Кол-во атомов алюминия, вступающих в реакцию:
4·1Al=4Al - Кол-во атомов углерода, вступающих в реакцию:
3·1C=3C - Окончательный вид уравнения:
4Al+3C = Al4+3C3-4
2. Составить уравнение реакции азотной кислоты с йодом.
- Схема реакции:
HNO3+I2 → HIO3+NO+H2O - Определяем элементы, меняющие свои степени окисления:
HN+5O3+I2 → HI+5O3+N+2O+H2O - Азот меняет степень окисления с +5 на +2 — принимает 3 электрона, и является окислителем:
N+5 → N+2
N+5+3e- → N+2 - Йод меняет степень окисления с 0 на +5 — отдает 5 электронов, и является восстановителем, но, поскольку молекула йода двухатомна, то в схеме она записывается в молекулярном виде, а кол-во отдаваемых электронов соответственно удваивается:
I2 → 2I+5
I2-10e- → 2I+5 - Уравниваем заряды:
10| 1N+5+3e- → 1N+2 3| 1I2-10e- → 2I+5
- Было до реакции 10·1N+5=10N+5, после реакции образовалось: 10·1N+2=10N+2
- В реакцию вступило всего 6 атомов йода (3·2) или три молекулы 3I2, после реакции образовалось 3·2I+5=6I+5;
-
Расставляем найденные коэффициенты:
10HNO3+3I2 = 6HIO3+10NO+2H2O
3. Составить уравнение реакции соляной кислоты (концентрированной) с оксидом марганца (IV).
- HCl+MnO2 → Cl2+MnCl2+H2O
- HCl-1+Mn+4O2 → Cl2+Mn+2Cl2+H2O
- Соляная кислота является восстановителем, оксид марганца — окислителем.
- Атом хлора отдает свой электрон, но в правой части нулевой заряд имеет молекула хлора, состоящая из двух атомов, поэтому, для ее получения нужны 2 электрона от двух атомов хлора:
Cl-1 → Cl2
2Cl—2e- → Cl2 - Атом марганца получает 2 электрона, снижая свою степень окисления с +4 до +2:
Mn+4 → Mn+2
Mn+4+2e- → Mn+2 - Поскольку, хлор отдает два электрона, а марганец эти же два электрона принимает, оба коэффициента будут равны 2, и их можно сократить:
1| 2Cl--2e- → Cl2 1| Mn+4+2e- → Mn+2
- Получаем уравнение, отличающееся от исходного только стехиометрическим коэффициентом 2, который стоит перед формулой соляной кислоты (два атома хлора отдают по одному электрону):
2HCl+MnO2 → Cl2+MnCl2+H2O - Осталось найти стехиометрические коэффициенты для остальных веществ, чтобы уравнять левую и правую части уравнения.
- В левой части уравнения 2 атома хлора, в правой — 4, чтобы уравнять атомы хлора, перед формулой соляной кислоты ставим 4, но, теперь в правой части уравнения получается на 2 атома водорода меньше, чтобы уравнять атомы водорода, перед молекулой воды ставим коэффициент 2 — теперь кол-во всех атомов в левой части и в правой части уравнения одинаково:
4HCl+MnO2 → Cl2+MnCl2+2H2O - Ионное уравнение реакции:
4H++4Cl-+MnO2 = Cl2+Mn2++2Cl-+2H2O
4. Составить уравнение реакции сероводорода с раствором калия перманганата в кислой среде.
- Схема реакции:
H2S+KMnO4+H2SO4 → S+MnSO4+K2SO4+H2O - Определяем элементы, меняющие свои степени окисления:
H2S-2+KMn+7O4+H2SO4 → S+Mn+2SO4+K2SO4+H2O - Сера меняет свою степень окисления с -2 до 0, т.е., отдает 2 электрона (сероводород — восстановитель):
S-2 → S
S-2-2e- → S - Марганец меняет свою степень окисления с +7 до +2, т.е., принимает 5 электронов (калия перманганат — окислитель):
Mn+7 → Mn+2
Mn+7+5e- → Mn+2 - Электронные уравнения:
5| S-2-2e- → S 2| Mn+7+5e- → Mn+2
- 5H2S+2KMnO4+H2SO4 = S+MnSO4+K2SO4+H2O
- 5H2S+2KMnO4+3H2SO4 = 5S+2MnSO4+K2SO4+8H2O
- Ионное уравнение:
5H2S+2MnO4-+6H+ = 5S+2Mn2++8H2O
Коррозия металлов и способы защиты от нее
Коррозией металла называют процесс его самопроизвольного разрушения в результате контакта с окружающей средой.
Коррозия бывает химическая и электрохимическая.
Химическая коррозия — вид коррозии, при котором металл разрушается из-за его взаимодействия с газами или жидкостями, не проводящими электрический ток. Так, например, к химической коррозии относится образование окалины при взаимодействии железа с кислородом при высоких температурах, а также разрушение металлического оборудования под действием нефтяных фракций, содержащих сернистые соединения.
Электрохимической коррозией называют разрушение металла в растворе электролита вследствие возникновения в данной системе электрических токов. Электрические токи, способствующие коррозии, возникают в тех случаях, когда в растворе электролита изделие из металла контактирует с другим менее активным металлом. Также такие токи могут появляться из-за химической неоднородности металлического материала, из которого выполнено изделие.
Так, например, из-за электрохимической коррозии страдают подводные части судов, паровые котлы, трубопроводы, металлические конструкции в почве и т.д.
Способы защиты металлов от коррозии
1) Контроль условий, в которых эксплуатируется металлическое оборудование. Например, хранение и использование изделий из стали на открытом воздухе нежелательно и этого, по возможности, следует избегать. Эксплуатация металлического оборудования в помещениях с низкой влажностью существенно продлит его срок службы.
2) Создание защитных покрытий, изолирующих металлоконструкцию от контакта с окружающей средой. Среди таких покрытий различают:
— неметаллические покрытия — всевозможные краски, лаки, эмали, а также пленки из таких полимеров, как полиэтилен, поливинилхлорид и т.д.;
— химические покрытия (оксидные, нитридные, фосфатные и т.д.) (Такие покрытия получают специальной химической обработкой поверхности металла.);
— металлические покрытия.
Металлические покрытия получают нанесением на защищаемую металлическую конструкцию тонкого слоя другого металла (чаще всего с помощью процесса электролиза).
При этом, если в качестве покрытия используется менее активный металл, то такое покрытие будет защищать металлоконструкцию только при условии его целостности. В случае, если целостность такого покрытия будет нарушена, защищаемый металл будет ускоренно корродировать.
Также широко используется покрытие металлоконструкций более активным металлом. Например, распространено использование так называемого оцинкованного железа. Такое покрытие защищает металлические объекты даже при нарушении его целостности, поскольку пока практически полностью не исчезнет слой покрытия из более активного металла, коррозия металла, из которого сделан защищаемый объект, не начнется.
3) Электрохимические методы защиты:
— катодная защита — вид защиты, при котором металлический объект подключается с помощью проводников к катоду внешнего источника тока либо же приводится в контакт с более активным металлом.
Частный случай катодной защиты, при котором металлическая конструкция приводится в контакт с более активным металлом, называют протекторной защитой.
4) Изменение химических свойств среды, в которой эксплуатируется металлическое изделие, в частности:
— добавление в среду веществ, замедляющих коррозию (ингибиторов коррозии).
— дегазация среды (удаление растворенных в ней газов, в частности, кислорода). Например, такой метод работает для защиты от ржавления железа, поскольку в процессе ржавления железа активное участие принимает не только вода, но и кислород:
4Fe + 6H2O + 3O2 = 4Fe(OH)3
Примеры веществ-восстановителей
Типичными восстановителями могут быть щелочные (IA) и щелочноземельные (IIA) металлы, цинк и алюминий, а также катионы металлов в своих низших степенях окисления при нескольких возможных. Например:
Fe + H2SO4 (разб) = FeSO4 + H2
6СuCl + K2Cr2O7 + 14HCl (разб) = 6CuCl2 + 2CrCl3 + 2KCl + 7H2O.
Типичными восстановителями также могут быть бескислородные кислоты и их соли. Например, H2S + 4Cl2 + 4H2O = 8HCl + H2SO4.
Гидриды активных металлов (щелочных и щелочноземельных) тоже являются типичными восстановителями. Например, NaH + H2O = NaOH + H2.
Для удобства мы собрали цвета переходов важнейших веществ-восстановителей в одном месте.

Правила ОВР
Эквивалентный обмен электронов и атомный баланс.
Кислая среда
В кислой среде высвобождающиеся оксид-ионы связываются с протонами в молекулы воды; недостающие оксид-ионы поставляются молекулами воды, тогда из них высвобождаются протоны.
Там, где не хватает атомов кислорода, пишем столько молекул воды, сколько не хватает оксид-ионов.
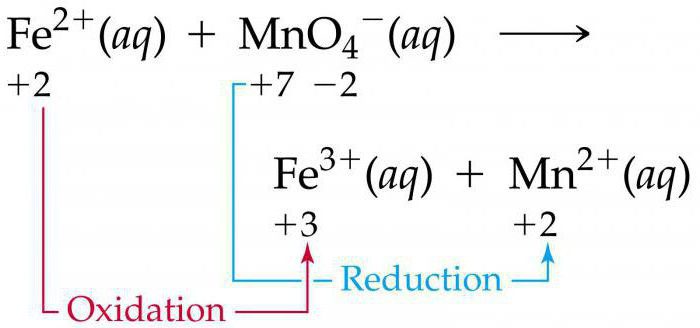
Пример. Используя метод электронного баланса, составить уравнение реакции, определить окислитель и восстановитель:
1. Определяем степень окисления: сера в сульфите калия имеет степень окисления +4, марганец в перманганате калия имеет степень окисления +7, серная кислота – среда протекания реакции.
Мараганец в высшей степени окисления – окислитель, следовательно, сульфит калия восстановитель.
Примечание: +4 – промежуточная степень окисления для серы, поэтому она может выступать как восстановителем, так и окислителем. С сильными окислителями (перманганат, дихромат) сульфит является восстановителем (окисляется до сульфата), с сильными восстановителями (галогенидами, халькогенидами) сульфит окислитель (восстанавливается до серы или сульфида).
Сера из степени окисления +4 переходит в +6 – сульфит окисляется до сульфата. Марганец из степени окисления +7 переходит в +2 (кислая среда) – перманганат ион восстанавливается до Mn2+.
2. Составляем полуреакции. Уравниваем марганец: Из перманганата высвобождаются 4 оксид-иона, которые связываются ионами водорода (кислая среда) в молекулы воды. Таким образом, 4 оксид-иона связываются с 8 протонами в 4 молекулы воды.
Другими словами, в правой части уравнения не хватает 4 кислорода, поэтому пишем 4 молекулы воды, в левой части уравнения – 8 протонов.
Семь минус два – плюс пять электронов. Можно уравнивать по общему заряду: в левой части уравнения восемь протонов минус один перманганат = 7+, в правой части марганец с зарядом 2+, вода электронейтральна. Семь минус два – плюс пять электронов. Все уравнено.
![]()
Уравниваем серу: недостающий оксид-ион в левой части уравнения поставляется молекулой воды, из которой впоследствии высвобожается два протона в правую часть.
Слева заряд 2-, справа 0 (-2+2). Минус два электрона.
![]()
3. Суммарное уравнение электронного баланса. Умножаем верхнюю полуреакцию на 2, нижнюю на 5.
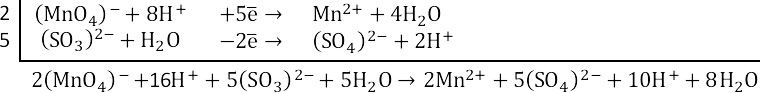
Сокращаем протоноы и воду.
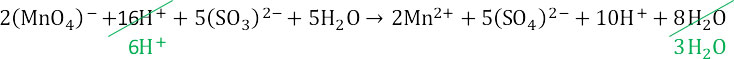
4. Итоговое уравнение реакции: Сульфат ионы связываются с ионами калия и марганца.
![]()
Щелочная среда
В щелочной среде высвобождающиеся оксид-ионы связываются молекулами воды, образуя гидроксид-ионы (OH– группы). Недостающие оксид-ионы поставляются гидроксо-группами, которых надо брать в два раза больше.
Там, где не хватает оксид-ионов пишем гидроксо-групп в 2 раза больше, чем не хватает, с другой стороны – воду.
Пример. Используя метод электронного баланса, составить уравнение реакции, определить окислитель и восстановитель:
Определяем степень окисления:
Висмут (III) с сильными окислителями (например, Cl2) в щелочной среде проявляет восстановительные свойства (окисляется до висмута V):
Так как в левой части уравнения не хватает 3 кислородов для баланса, то пишем 6 гидроксо-групп, а справа – 3 воды.
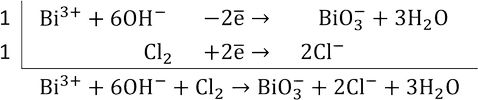
Итоговое уравнение реакции:
![]()
Нейтральная среда
В нейтральной среде высвобождающиеся оксид-ионы связываются молекулами воды с образованием гидроксид-ионов (OH– групп). Недостающие оксид-ионы поставляются молекулами воды. Из них высвобождаются ионы H+.
Используя метод электронного баланса, составить уравнение реакции, определить окислитель и восстановитель:
1. Определяем степень окисления: сера в персульфате калия имеет степень окисления +7 (является окислителем, т.к. высшая степень окисления), бром в бромиде калия имеет степень окисления -1 (является восстановителем, т.к. низшая степень окисления), вода – среда протекания реакции.
Сера из степени окисления +7 переходит в +6 – персульфат восстанавливается до сульфата. Бром из степени окисления -1 переходит в 0 – бромид ион окисляется до брома.
2. Составляем полуреакции. Уравниваем серу (коэффициент 2 перед сульфатом). Кислород уравнен.
В левой части заряд 2-, в правой части заряд 4-, присоединено 2 электрона, значит пишем +2
Уравниваем бром (коэффициент 2 перед бромид-ионом). В левой части заряд 2-, в правой части заряд 0, отдано 2 электрона, значит пишем –2
3. Суммарное уравнение электронного баланса.
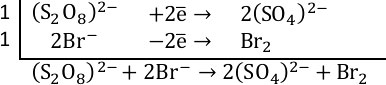
4. Итоговое уравнение реакции: Сульфат ионы связываются с ионами калия в сульфат калия, коэффициент 2 перед KBr и перед K2SO4. Вода оказалась не нужна – заключаем в квадратные скобки.
![]()
Второй пример
ОВР в органической химии рассматривается по такому же алгоритму, есть только некоторые отличия в расстановке степеней окисления. Одно из заданий ЕГЭ посвящено вопросам, связанным с расстановкой коэффициентов в ОВР. Для успешного выполнения данного задания сначала школьники должны подумать, какие недостающие вещества им нужно вписать, и только после этого переходить к алгоритму разбора ОВР.

Например, с помощью электронного баланса необходимо составить уравнение:
PH3 + AgNO3 +… = Ag + HNO3
Для начала выявим, какое вещество пропущено в левой части данного взаимодействия. С учетом того, что серебро проявляет окислительные свойства, а фосфор будет восстановителем, недостающим веществом станет вода.
При составлении электронного баланса, получаем следующий вид:
P(-3) отдает 8 электронов = P(+5) 1
Ag(+) принимает электрон = Ag(0) 8
При расстановке коэффициентов, получаем запись процесса:
PH3 + 8 AgNO3 + 4H2O = 8Ag + 8HNO3 + H3PO4
PH3 — восстановитель, AgNO3 — окислитель

































