Химические свойства одноатомных спиртов
Общая формула одноатомных предельных спиртов: CnH2n+1OH. В спиртах, одноатомных и многоатомных, помимо связи между углеродом и водородом (С—ОН), есть еще одна связь между кислородом и водородом (О—Н). Поэтому химические реакции проходят с разрывом одной из цепей:
-
реакции восстановления проходят с отщеплением гидроксильной группы от молекулы спирта;
-
реакции окисления — с отщеплением водорода.
Низшие спирты (метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин) смешиваются с водой в любых соотношениях.
Кислотно-основные свойства
Согласно теории Бренстеда-Лоури спирты — достаточно слабые кислоты. Кислотность спиртов уменьшается по мере усложнения углеродного скелета.
-
Взаимодействие со щелочными металлами:
2С2Н5ОН + 2Na → 2C2H5ONa + H2. -
Взаимодействие со щелочами:
С2H5OH + NaOH ⇄ C2H5ONa + H2O.
Спирты — более слабые кислоты, чем вода, поэтому невозможна реакция с водными растворами щелочей. Взаимодействие с твердыми щелочами возможно, реакция обратима. Равновесие сильно смещено влево.
Основность кислот увеличивается по мере увеличения углеродного скелета.
Замещение гидроксогруппы
Гидроксогруппа является плохо уходящей. Энергия разрыва связи С—О довольно высока, поэтому непосредственное замещение группы ОН на другую группу невозможно.
Для того, чтобы замещение было возможно, группу ОН превращают в хорошо уходящую, т. е. понижают энергию разрыва связи. Для этого:
-
проводят реакцию в кислой среде;
-
переводят гидроксигруппу в сульфогруппу применяя H2SO4;
-
применяют кислоты Льюиса.
R—OH + PCl5 → R—Cl + POCl3 + HCl
R—OH + SOCl2 → R—Cl + SO2 + HCl
R—OH + HCl → R—Cl + H2O
R—OH + PBr → R—Br + H3PO3
R—OH + KBr + H2SO4 → R—Br + KHSO4 + H2O
Реакция с использованием реактива Лукаса
Реактив Лукаса — это смесь ZnCl2 и HCl. Скорость реакции убывает при упрощении углеродного скелета. Внешним признаком реакции служит расслоение реакционной смеси в случае образования хлоруглеводорода R—Cl, представляющего собой маслообразное нерастворимое вещество.
Быстрее всего реагируют третичные спирты, слой нерастворимого алкилгалогенида появляется фактически сразу же после смешения реагентов — меньше чем за минуту.
Вторичные спирты вначале растворяются в реактиве, но затем раствор мутнеет, в течение 5 минут появляются капли алкилгалогенида.
Растворы первичных спиртов остаются прозрачными, они образуют хлориды только при нагревании.
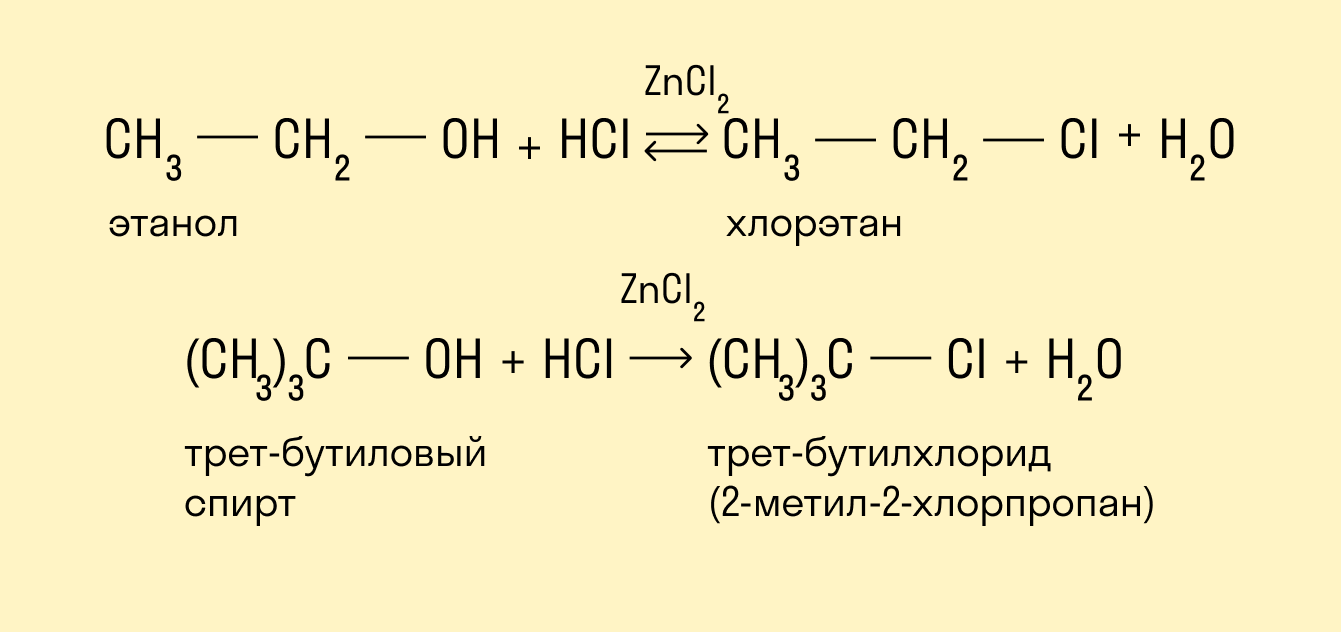
Дегидратация спиртов
При температуре &rt; 140°C и в присутствии серной кислоты происходит внутримолекулярная дегидратация. В результате реакции получается алкен.
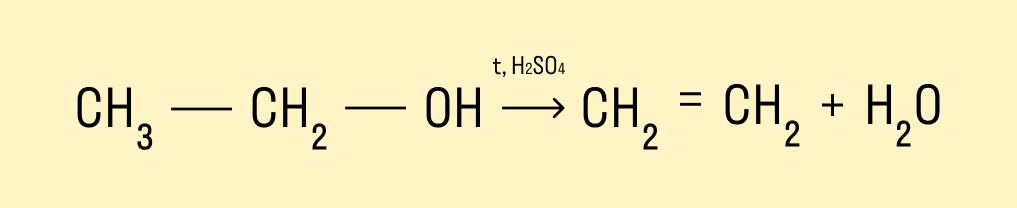
При температуре < 140°C и в присутствии серной кислоты происходит межмолекулярная дегидратация. В результате образуется простой эфир.

Реакция этерификации — получение сложных эфиров
Предельные одноатомные спирты вступают в химические реакции с карбоновыми кислотами, продукты таких реакций — сложные эфиры.
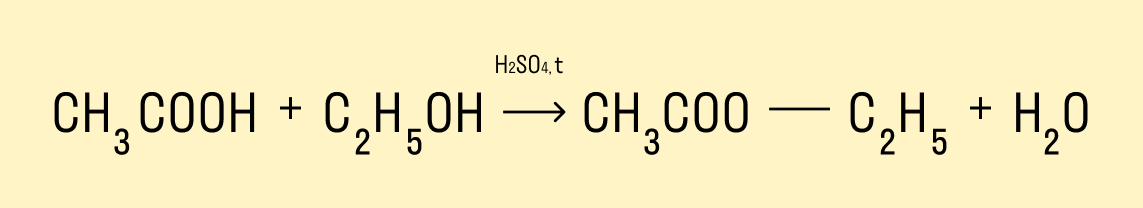
Взаимодействие с аммиаком
Эта реакция происходит при нагревании и в присутствии катализатора. Гидроксогруппа замещается на аминогруппу. Продукт реакции — амин.
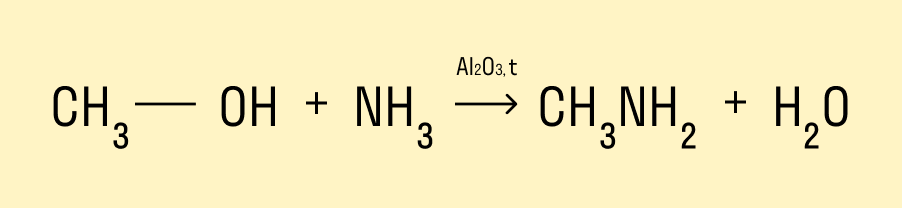
Окисление
-
Горение спиртов:
C2H5OH + 3O2 → 2CO2 + 3H2O. -
Жидкофазное окисление с применением хромовой смеси K2Cr2O7 + H2SO4:
3C2H5OH + K2Cr2O7 + 4H2SO4 → 3CH3COOH + K2SO4 + Cr2(SO4)3 + H2O. -
Окисление оксидом меди (II) при нагревании:
CH3—CH2—OH + CuO → CH3—CHO + Cu + H2O.
Первичные спирты при окислении образуют альдегиды, вторичные переходят в кетоны, третичные окисляются с разрушением углеродного скелета.
Химические свойства кислот
Борная кислота
Муравьиная кислота
Взаимодействие с основными оксидами с образованием соли и воды:
- CaO + 2HCl ⟶ CaCl2 + H2O
Взаимодействие с амфотерными оксидами с образованием соли и воды:
- ZnO + 2HNO3 ⟶ Zn(NO3)2 + H2O
Взаимодействие со щелочами с образованием соли и воды (реакция нейтрализации):
- NaOH + HCl ⟶ NaCl + H2O
Взаимодействие с нерастворимыми основаниями с образованием соли и воды, если используемая кислота растворима:
- Cu(OH)2↓ + H2SO4 ⟶ CuSO4 + 2H2O
Взаимодействие с солями, если выпадает осадок или выделяется газ:
- BaCl2 + H2SO4 ⟶ BaSO4↓ + 2HCl↑
Сильные кислоты вытесняют более слабые из их солей:
- K3PO4 + 3HCl ⟶ 3KCl + H3PO4
- Na2CO3 + 2HCl ⟶ 2NaCl + H2O + CO2↑
(в данном случае образуется неустойчивая угольная кислота H2CO3 , которая сразу же распадается на воду и углекислый газ)
Металлы, стоящие в ряду активности до водорода, вытесняют его из раствора кислоты (кроме азотной кислоты HNO3 любой концентрации и концентрированной серной кислоты H2SO4), если образующаяся соль растворима:
- Mg + 2HCl ⟶ MgCl2 + H2↑
С азотной кислотой и концентрированной серной кислотами реакция идёт иначе:
- Mg + 2H2SO4 ⟶ MgSO4 + SO2↑ + 2H2O
Для органических кислот характерна реакция этерификации (взаимодействие со спиртами с образованием сложного эфира и воды):
- R1 − COOH + R2 − OH ⟶ R1 − COO − R2 + H2O
Например:
- CH3COOH + C2H5OH ⟶ CH3COOC2H5 + H2O
Получение кислот
Кислоты получают:
Путём взаимодействия неметаллов с водородом:
-
- H2 + Cl2 → 2HCl
-
- H2 + S → H2S
Путём взаимодействия серной кислоты с твёрдыми солями:
Нелетучая серная кислота при нагревании способна вытеснять летучие кислоты из их солей
-
- 2NaCl + H2SO4 → Na2SO4 + 2HCl
-
- Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
Путём взаимодействия кислотных оксидов с водой:
-
- P2O5 + 3H2O → 2H3PO4
Химические свойства
Общие свойства, характерные для класса кислот (как органических, так и неорганических), обусловлены наличием в молекулах гидроксильной группы, содержащей сильно полярную связь между атомами водорода и кислорода. Эти свойства вам хорошо известны. Рассмотрим их еще раз на примере растворимых в воде органических кислот.
1. Диссоциация с образованием катионов водорода и анионов кислотного остатка. Более точно этот процесс описывает уравнение, учитывающее участие в нем молекул воды.
Равновесие диссоциации карбоновых кислот смещено влево, подавляющее большинство их — слабые электролиты. Тем не менее кислый вкус, например, муравьиной и уксусной кислот объясняется диссоциацией на катионы водорода и анионы кислотных остатков.
Очевидно, что присутствием в молекулах карбоновых кислот «кислого» водорода, т. е. водорода карбоксильной группы, обусловлены и другие характерные свойства.
2. Взаимодействие с металлами, стоящими в электрохимическом ряду напряжений до водорода. Так, железо восстанавливает водород из уксусной кислоты:2СН3—СООН + Fe —> (CHgCOO)2Fe + Н2
3. Взаимодействие с основными оксидами с образованием соли и воды:2R—СООН + СаО —> (R—СОО)2Са + Н20
4. Взаимодействие с гидроксидами металлов с образованием соли и воды (реакция нейтрализации):R—СООН + NaOH —> R—COONa + Н20 3R—СООН + Са(ОН)2 —> (R—СОО)2Са + 2Н20
5. Взаимодействие с солями более слабых кислот, с образованием последних. Так, уксусная кислота вытесняет стеариновую из стеарата натрия и угольную из карбоната калия.
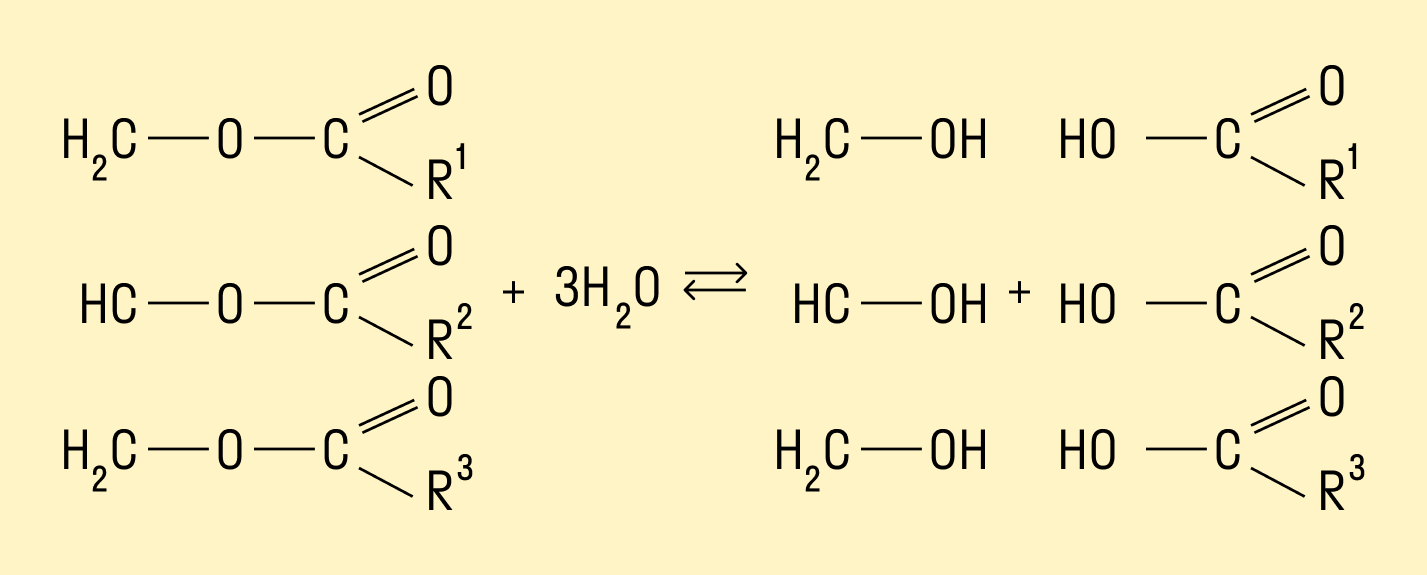
6. Взаимодействие карбоновых кислот со спиртами с образованием сложных эфиров — уже известная вам реакция эте-рификации (одна из наиболее важных реакций, характерных для карбоновых кислот). Взаимодействие карбоновых кислот со спиртами катализируется катионами водорода.
Реакция этерификации обратима. Равновесие смещается в сторону образования сложного эфира в присутствии водоотни-мающих средств и удалении эфира из реакционной смеси.
В реакции, обратной этерификации, которая называется гидролизом сложного эфира (взаимодействие сложного эфира с водой), образуются кислота и спирт. Очевидно, что реагировать с карбоновыми кислотами, т. е. вступать в реакцию этерификации, могут и многоатомные спирты, например глицерин: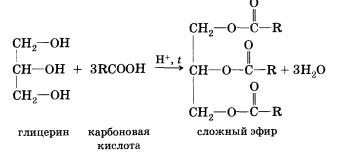
Dсе карбоновые кислоты (кроме муравьиной) наряду с карбоксильной группой содержат в молекулах углеводородный остаток. Безусловно, это не может не сказаться на свойствах кислот, которые определяются характером углеводородного остатка.
7. Реакции присоединения по кратной связи — в них вступают непредельные карбоновые кислоты; например, реакция присоединения водорода — гидрирование. При гидрировании олеиновой кислоты образуется предельная стеариновая кислота.
Непредельные карбоновые кислоты, как и другие ненасыщенные соединения, присоединяют галогены по двойной связи. Так, например, акриловая кислота обесцвечивает бромную воду.
8. Реакции замещения (с галогенами) — в нее способны вступать предельные карбоновые кислоты; например, при взаимодействии уксусной кислоты с хлором могут быть получены различные хлорпроизводные кислоты:
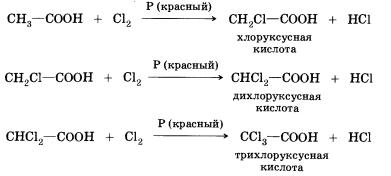
При галогенировании карбоновых кислот, содержащих более одного атома углерода в углеводородном остатке, возможно образование продуктов с различным положением галогена в молекуле. При протекании реакции по свободнорадикальному механизму могут замещаться любые атомы водорода в углеводородном остатке. Если же реакцию проводить в присутствии небольших количеств красного фосфора, то она идет селективно — водород замещается лишь в а-положении (у ближайшего к функциональной группе атома углерода) в молекуле кислоты. Причины такой селективности вы узнаете при изучении химии в высшем учебном заведении.
Карбоновые кислоты образуют различные функциональные производные при замещении гидроксильной группы. При гидролизе этих производных из них вновь образуется карбоновая кислота.
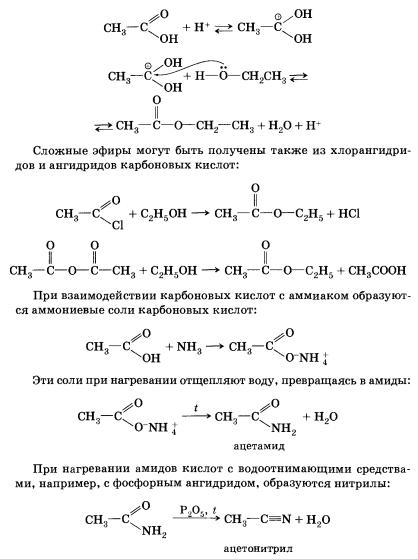
Хлорангидрид карбоновой кислоты можно получить действием на кислоту хлорида фосфора(ІІІ) или тионилхлорида (SОСl2). Ангидриды карбоновых кислот получают взаимодействием хлор-ангидридов с солями карбоновых кислот. Сложные эфиры образуются в результате этерификации карбоновых кислот спиртами. Этерификация катализируется неорганическими кислотами.
Эту реакцию инициирует протонирование карбоксильной группы — взаимодействие катиона водорода (протона) с неподеленной электронной парой атома кислорода. Протонирование карбоксильной группы влечет за собой увеличение положительного заряда на атоме углерода в ней:
Получение спиртов
Гидролиз галогенопроизводных алканов
Галогенпроизводные алканов реагируют с водным раствором щелочей, результатом реакции является образование спиртов. Атом галогена в галогеналкане замещается на гидроксогруппу.
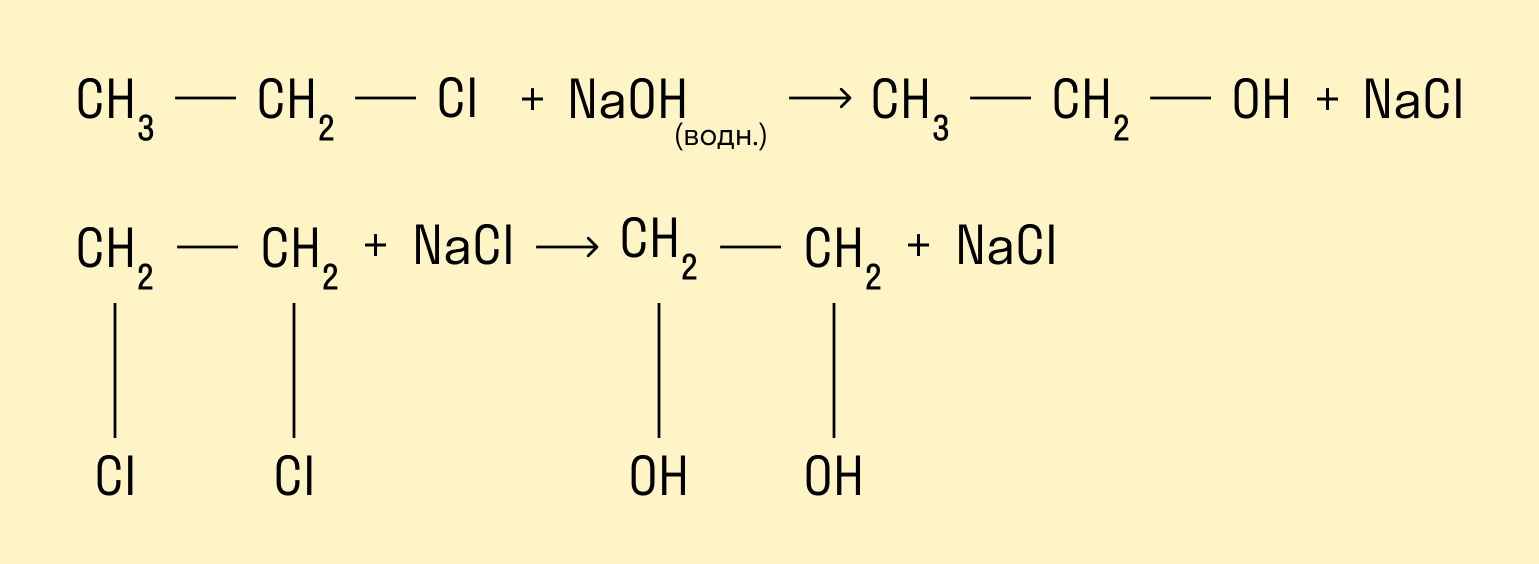
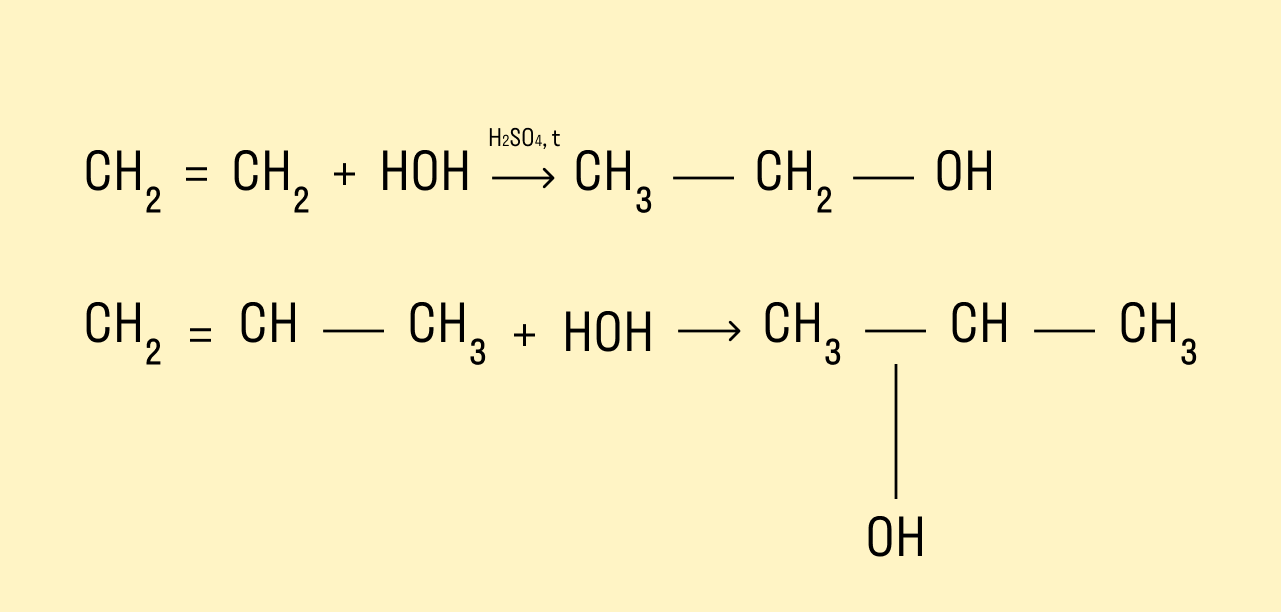
Гидратация алкенов
Присоединение молекул воды происходит в присутствии минеральных кислот и при нагревании.
Если в реакцию вступают несимметричные алкены, то процесс гидратации подчиняется правилу Марковникова. Атом водорода присоединяется к наиболее гидрированному атому углерода, а гидроксогруппа соединяется с соседним атомом углерода, наименее гидрированным.
Восстановление альдегидов и кетонов
Восстановление проводят каталитическим гидрированием карбонильной группы. Катализаторами могут быть никель, платина, палладий. Первичные спирты образуются из альдегидов, вторичные — из кетонов.
СН3—СНО + Н2 → CH3—CH2—OH
CH3—C(O)—CH3 + H2 → CH3—CH(OH)—CH3
Альдегиды и кетоны можно восстанавливать, действуя на них разными восстановителями, например, комплексным алюмогидридом лития LiAlH4.
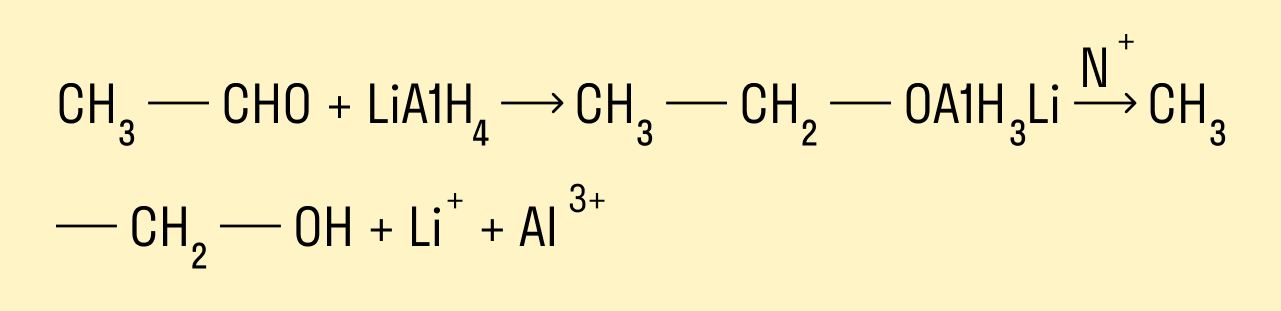
Реакция Канниццаро
Это окислительно-восстановительная реакция диспропорционирования альдегидов в первичные спирты и карбоновые кислоты под действием оснований.
2СH3—CHO + NaOH → CH3—CH2—OH + CH3—COONa
Гидролиз сложных эфиров
Процесс гидролиза заключается в том, что под действием воды происходит расщепление сложных эфиров. Гидролиз может протекать в кислой и щелочной среде. Гидролиз в щелочной среде является процессом необратимым, так как происходит омыление, т. е. образование солей карбоновых кислот.
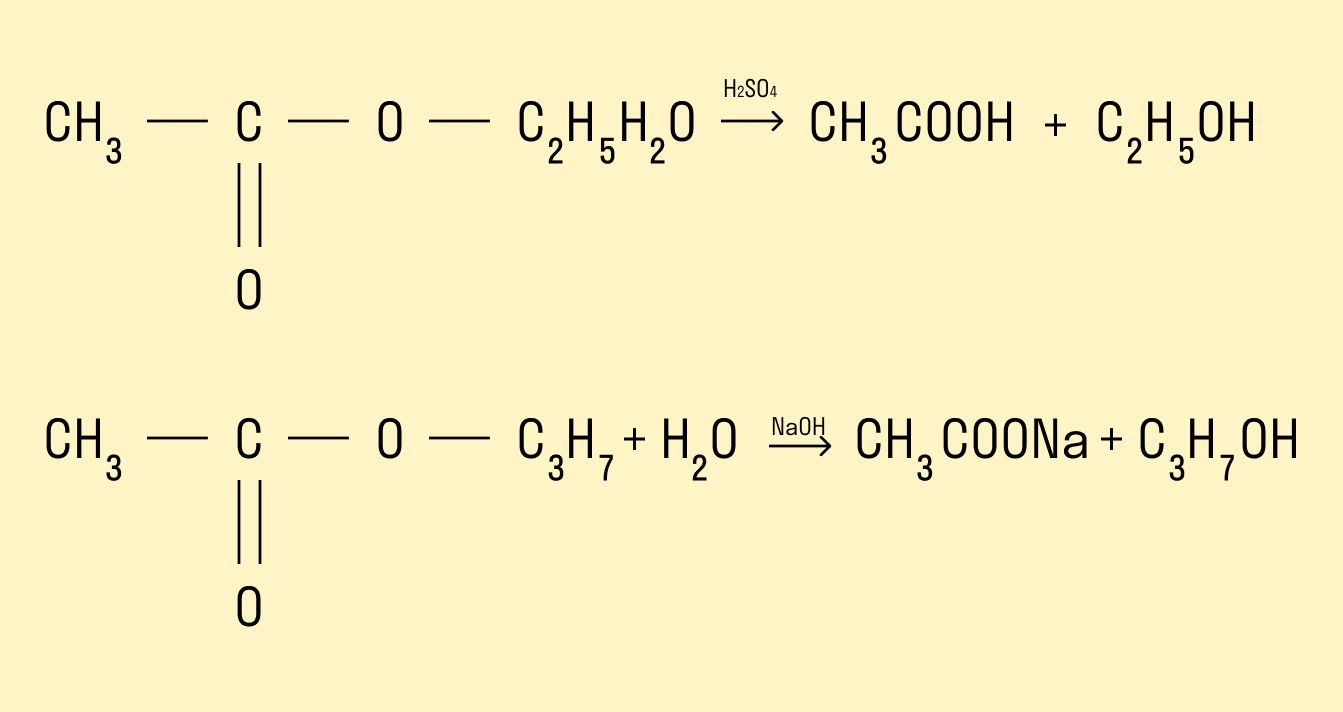
Синтез Гриньяра
Синтез с использованием реактива Гриньяра. Реактивы Гриньяра — магнийорганические соединения, содержащие ковалентную связь C—Mg. Чаще всего их получают из органилгалогенидов вида R—X, где X = Cl, Br, I и магния в безводной среде.
-
Первичные спирты получают из муравьиного альдегида.
-
Уксусный альдегид и другие альдегиды дают вторичные спирты.
-
Кетоны и сложные эфиры образуют третичные спирты.
Получение метанола из синтез-газа
Основной промышленный метод получения метанола состоит из двух этапов:
-
Получение синтез-газа с помощью паровой, парокислородной или пароуглекислотной конверсии природного газа.
-
Синтез метанола путем восстановления оксида и диоксида углерода водородом на катализаторе.
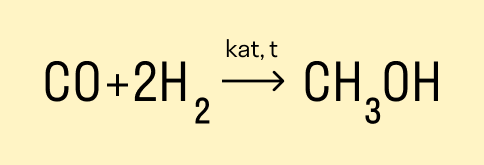
Этанол можно получить путем ферментативного брожения глюкозы (спиртовое брожение).
С6Н12О6 → 2C2H5OH + 2CO2
Реакция Вагнера
Окисление алкенов холодным раствором перманганатом калия в нейтральной среде (реакция Вагнера).
3CH2=CH2 + 2KMnO4 + 4H2O → HO—CH2—CH2—OH + 2MnO2 + 2KOH
Гидролиз жиров
Многоатомные спирты можно получить путем гидролиза жиров. При взаимодействии кислот с жирами происходит образование глицерина и карбоновых кислот.
Х и м и я
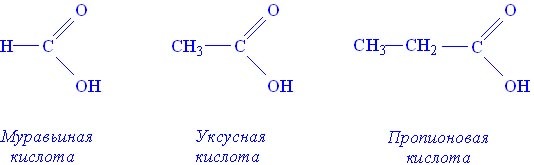
Карбоновые кислоты — это органические соединения, которые характеризуются присутствием в их молекулах карбоксильной группы -СООН.
Карбоксильная группа является функциональной (характеристической) группой этого класса соединений. Примерами карбоновых кислот могут служить:
Кислотный характер этих соединений является результатом того, что атом водорода гидроксильной группы способен диссоциировать с образованием иона водорода, например:
![]()
Взаимодействуя с основаниями карбоновые кислоты образуют соли:
![]()
Карбоновые кислоты являются слабыми кислотами, поэтому их соли подвергаются обратимоми гидролизу. Наиболее сильные из карбоновых кислот – муравьиная и уксусная.
Карбоновые кислоты со спиртами образуют сложные эфиры
Сложные эфиры – чрезвычайно важное соединение, очень часто встречающееся в продуктах животного и растительного мира
Классификация карбоновых кислот
Карбоновые кислоты можно классифицировать по различным признакам:
- По количеству гидрокильных групп (одно- и двухосновные),
- По числу атомов углерода (низшие, средние, высшие),
- По наличию в них предельных и не предельных связей (предельные и непредельные).
Одноосновные и двухосновные карбоновые кислоты
Карбоновые кислоты делятся одноосновные и двухосновные в зависимости от кличества в их составе гидроксильных групп ОН.
Все карбоновые кислоты, рассмотренные выше – это примеры одноосновных кислот. В их сотавах содержится по одной гидроксильной группе.
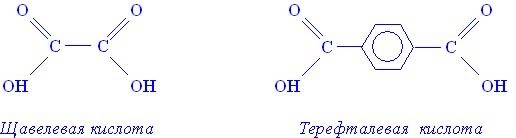
Соответственно, в молекулах двухосновных кислот содержится по две гидроксильных группы. К двухосновным карбоновым кислотам относятся, например, щавелевая или терефталиевая кислоты.
Низшие, средние и высшие карбоновые кислоты
- По числу атомов углерода в молекуле карбоновые кислоты делят на:
- Низшие (С1-С3),
- Средние (С4-С8) и
- Высшие (С9-С26).
- Высшие карбоновые кислоты называют высшими жирными кислотами, по причине того, что они входят в состав природных жиров.
Но иногда жирными называют все ациклические карбоновые кислоты.
Таким образом, термины «жирные кислоты» и «карбоновые кислоты» часто используются как синонимы.
Предельные и непредельные карбоновые кислоты
Предельные карбоновые кислоты в своём составе, содержат радикал предельных углеводородов, т.е. радикал только с простыми, одинарными связями.
И наоборот, непредельные карбоновые кислоты в своём составе содержат радикал непредельных углеводородов, т.е. радикал, в котором присутствуют кратные (двойные и тройные) связи.
Высшие карбоновые (жирные) кислоты
Напомним, что высшим карбоновым кислотам относят такие карбоновые кислоты, молекулы которых содержат сравнительно большое число атомов углерода (С9-С26).
По причине того, что высшие карбоновые кислоты входят в состав животных и растительных жиров их называют высшими жирными кислотами.
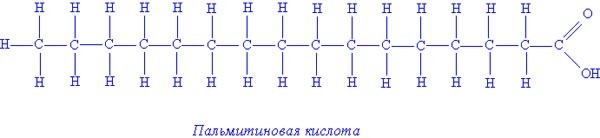
Примеры предельных высших жирных кислот:
- Каприновая кислота — C9H19COOH,
- Лауриновая кислота — С11Н23СООН,
- Миристиновая кислота — С13Н27СООН,
- Пальмитиновая кислота — С15Н31СООН,
- Стеариновая кислота – С17Н35СООН.
Примеры непредельных высших жирных кислот:
- Олеиновая кислота — С17Н33СООН – имеет одну двойную связь,
- Линолевая кислота – С17Н31СООН — имеет две двойных связи,
- Линоленовая кислота – С17Н29СООН – имеет три двойных связи.
Структурные формулы соединений, в которых присутствуют длинные углеводородный радикалы, часто изображают следующим образом:
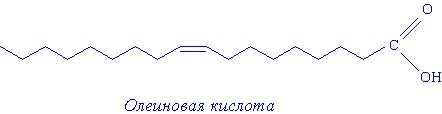
В углеводородной цепи атомы углерода расположены не по прямой линии, а виде «змейки». Угол между двумя соседними отрезками такой «змейки» 109 градусов 28 минут. В случае двойной связи угол другой.
В структурной формуле каждая вершина такой «змейки» означает атом углерода, соединённый с двумя атомами водорода. Последний атом углерода соединён с тремя атомами водорода. При этом сами символы углерода (С) и водорода(Н) не изображаются.
- Предельные и непредельные жирные кислоты имеют в значительной степени различные свойства.
- Высшие предельные кислоты – воскообразные вещества, непредельные – жидкости (напоминающие растительное масло).
- Натриевые и калиевые соли высших жирных кислот называют мылами.
- Например:
- C17H35COONa – стеарат натрия,
- С
Разница между одноосновными двухосновными и трехосновными кислотами
Определение
Одноосновная кислота: Одноосновные кислоты представляют собой кислотные соединения, которые имеют один замещаемый атом водорода на молекулу кислоты.
Двухосновная кислота: Двухосновные кислоты представляют собой химические соединения, которые имеют два заменяемых атома водорода на молекулу кислоты.
Трехосновная кислота: Трехосновные кислоты представляют собой химические соединения, которые имеют три замещаемых атома водорода на молекулу кислоты.
Ионы водорода, пожертвованные для кислотно-основных реакций
Одноосновная кислота: Одноосновные кислоты могут пожертвовать только один ион водорода для кислотно-щелочной реакции.
Двухосновная кислота: Двухосновные кислоты могут пожертвовать два иона водорода для кислотно-основной реакции.
Трехосновная кислота: Трехосновные кислоты могут пожертвовать три иона водорода для кислотно-щелочной реакции.
диссоциация
Одноосновная кислота: Одноосновные кислоты не имеют ступенчатой диссоциации.
Двухосновная кислота: Двухосновные кислоты диссоциируют в две стадии.
Трехосновная кислота: Трехосновные кислоты диссоциируют в три этапа.
Константы диссоциации
Одноосновная кислота: Одноосновные кислоты имеют только одну константу диссоциации.
Двухосновная кислота: Двухосновные кислоты имеют две константы диссоциации.
Трехосновная кислота: Трехосновные кислоты имеют три константы диссоциации.
Заключение
Кислоты — это соединения, которые могут выделять протоны (или Н+ ионы) в систему. Поэтому присутствие кислоты обозначается низким значением рН этой системы. Кислотность системы зависит от типа кислоты, присутствующей в этой системе. Кислоты в основном подразделяются на сильные и слабые кислоты. В зависимости от количества протонов, которые эти кислоты жертвуют для кислотно-щелочной реакции, кислоты также могут быть сгруппированы в одноосновные кислоты и многоосновные кислоты. Двухосновные кислоты и трехосновные кислоты являются многоосновными кислотами. Основное различие между одноосновными двухосновными и трехосновными кислотами состоит в том, что одноосновная кислота имеет только один замещаемый атом водорода, а двухосновные кислоты имеют два заменяемых водорода, тогда как трехосновные кислоты имеют три заменяемых атома водорода.
Применение органических соединений
Применение карбоновых кислот широко распространено в промышленности и быту. Так, НСООН обладает выраженными антибактериальными свойствами. Применяется для изготовления клеев, лаков, красителей. Сложные эфиры вещества — это растворители для пахнущих веществ.
Известный всем муравьиный спирт применяется в медицине в качестве противовоспалительного, болеутоляющего средства. Рефлекторно действует как раздражитель. НСООН используется для повышения срока хранения сена, силоса, потому что это вещество замедляет процесс гниения и распада органических веществ.
Уксус находит широкое применение не только как добавка к пище и для приготовления консервов. С ее помощью можно легко синтезировать лаки, красители для тканей. Огромные количества СН3СООН расходуются для выработки широко используемого ацетатного волокна, пластмассы, кинопленки, устойчивой к воспламенению и возгоранию, ядов, органического стекла. Ацетаты широко используются в сельском хозяйстве как эффективные ядохимикаты.
Несмотря на отвратительный запах прогорклого масла, С3Н7СООН используется для терапии патологий пищеварительного тракта. Она регулирует кишечную перистальтику, способствует развитию полезных бактерий. Сложные эфиры этого вещества имеют приятный запах, а поэтому они применяются в качестве основы для парфюмерной композиции.
Стеарин и пальмитин используют в процессе реакций с глицерином и образует мыло. Косметические вещества быстро впитываются и не вызывают аллергии. В химии применяют одноосновные карбоновые кислоты с более высоким углеродным числом.
Щавелевая применяется почти во всех отраслях промышленности благодаря ее уникальным свойствам.
Классификация кислот
Кислоты делятся на две группы:
- неорганические;
- органические.
Неорганические кислоты имеют общую формулу HnK, где K — кислотный остаток. Классифицируют их по нескольким показателям:
- Наличие кислорода в кислотном остатке: кислородсодержащие (H3PO4, HNO3) и бескислородные (H2S, HCl).
- Основность (количество атомов водорода, способных заместиться на металл): одноосновные (HBr, HNO3), двухосновные (H2SO4, H2CO3), трехосновные (H3PO4).
- Летучесть: летучие (H2S, HNO3), нелетучие (H2SO4, H3PO4).
- Степень диссоциации: сильные (HNO3, HCl) и слабые (H2CO3, HClO).
- Устойчивость: стабильные (H2SO4, H3PO4) и нестабильные (распадаются, H2SO3, H2CO3).
- Растворимость в воде: нерастворимые (H2SiO3 и H3BO3) и растворимые — все остальные.
- Агрегатное состояние, в котором могут быть: газообразные (H2S, HCl), жидкие (H2SO4, HNO3) и твердые (H3PO4, H3BO3,H2SiO3).
Органические кислоты: наиболее широко распространены карбоновые кислоты — соединения, в состав которых входит карбоксильная группа -COOH. Общая формула: R-COOH, где R — углеводородный радикал. Они играют важную роль в биохимии живых организмов, участвуют в процессах обмена веществ.
1. Карбоновые кислоты классифицируют по следующим признакам:
- число карбоксильных групп:
- одноосновные: муравьиная H-COOH и уксусная CH3-COOH;
- двухосновные: щавелевая HOOC-COOH, малоновая; HOOC-CH2-COOH
- многоосновные: лимонная кислота (HOOC-CH2)2-C(OH)-COOH.
- тип углеводородного радикала:
- предельные: CH3CH2CH2COOH масляная кислота;
- непредельные: CH2=CH-CH2COOH акриловая кислота;
- ароматические: C6H5COOH бензойная кислота;
- алициклические: C4H6O2 циклопропанкарбоновая кислота;
- гетероциклические: C6H5NO2 никотиновая кислота:
- замещенные карбоновые кислоты, в состав которых входит карбоксильная группа -COOH, углеводородный радикал R и различные функциональные группы. Некоторые из них:
- галогены → галогенкарбоновые кислоты, Hal-R-COOH (хлоруксусная кислота СlСН2СООН, трифторуксусная кислота CF3COOH);
- -OH → гидроксикислоты, OH-R-COOH (гликолиевая кислота HOCH2COOH, молочная кислота СH3CH(OH)COOH);
- -NH2 → аминокислоты, H2N-R-COOH (аминоуксусная кислотаCH2NH2-COOH глицин; 1,2- амино-3-метилпентановая кислота HO2CCH(NH2)CH(CH3)CH2CH3 изолейцин). Аминокислоты — главная составная часть белков.
2. Серосодержащие органические кислоты (сульфокислоты) содержат сульфогруппы и имеют общие формулы кислот: RSO3H → сульфоновые; RSO2H → сульфиновые; RSOH → сульфеновые. Наиболее известны: 2-аминоэтансульфоновая кислота C2H7NO3S таурин и 2-амино-3-меркаптопропановая кислота HO2CCH(NH2)CH2SH цистеин.
3. Нуклеиновые кислоты — высокомолекулярные соединения, состоящие из нуклеотидов. Играют важную роль в биологии: находятся в клетках всех организмов, являются носителями генов, участвуют в передаче и реализации наследственной информации через синтез белка. Типы нуклеиновых кислот в зависимости от моносахарида-основы:
- дезоксирибонуклеиновая кислота (ДНК) — дезоксирибоза (C5H10O4);
- рибонуклеиновая кислота (РНК) — рибоза (C5H10O5).
В нефтяной отрасли
Определенные смеси производных нефти, которые включают разнообразную комбинацию ароматических углеводородов, парафинов и полиядерных ароматических углеводородов, можно сульфировать, а затем соответствующим образом нейтрализовать с образованием так называемых нефтяных сульфонатов.
Эти нефтяные сульфонаты обладают свойством снижать поверхностное натяжение нефти в воде. К тому же его изготовление отличается очень низкой стоимостью.
По этой причине нефтяные сульфонаты закачиваются в существующие нефтяные скважины, помогая извлекать сырую нефть, застрявшую между породами под поверхностью.
§ 31. Карбоновые кислоты. Классификация
Карбоновые кислоты. Классификация
Вы уже знакомы со спиртами и альдегидами — органическими соединениями, молекулы которых содержат гидроксильные и альдегидные группы. Наличие этих групп обусловливает характерные химические свойства указанных классов соединений, поэтому данные группы называют функциональными.
В молекулах карбоновых кислот содержится карбоксильная функциональная группа:Как видно, карбоксильная группа сочетает в себе карбонильную и гидроксильную группы:
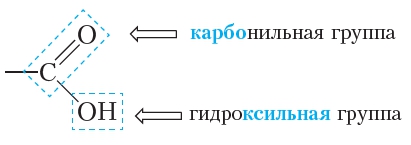
Название «карбоксильная группа» также является сочетанием названий этих двух групп.
Формула карбоксильной группы в сокращённом виде: —СООН.
В молекуле простейшей карбоновой кислоты, карбоксильная группа связана с атомом водорода:Это соединение называется муравьиная кислота. Шаростержневая модель молекулы муравьиной кислоты:
В молекуле ближайшего гомолога муравьиной кислоты карбоксильная группа связана с метильным радикалом:
Название этого соединения вам хорошо знакомо — это уксусная кислота. Шаростержневая модель молекулы уксусной кислоты:
Составим общую формулу гомологов уксусной кислоты. В молекулах таких кислот группа —COOH соединена с алкильным радикалом или водородом. Общая формула алкильных радикалов CnH2n+1
Тогда общая формула гомологов уксусной кислоты:
Обратите внимание, что для муравьиной кислоты n = 0.
В рассмотренных кислотах углеводородный радикал не содержит кратных связей. Такие карбоновые кислоты называются насыщенными.
Углеводородный радикал карбоновых кислот может содержать одну или несколько кратных связей. Такие кислоты называются ненасыщенными карбоновыми кислотами. Простейшая ненасыщенная карбоновая кислота — акриловая. Её структурная формула:
Карбоновые кислоты, в молекулах которых имеются бензольные кольца, называются ароматическими карбоновыми кислотами. Простейшим представителем таких кислот является бензойная кислота:
Шаростержневая модель молекулы бензойной кислоты: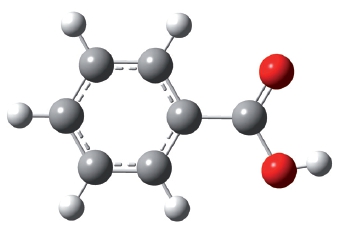 Молекулы карбоновых кислот могут содержать не только одну, но и несколько карбоксильных групп. Число карбоксильных групп в молекуле карбоновой кислоты определяет её основность. Кислоты, содержащие одну карбоксильную группу, являются одноосновными — это муравьиная, уксусная, акриловая, бензойная и другие кислоты.
Молекулы карбоновых кислот могут содержать не только одну, но и несколько карбоксильных групп. Число карбоксильных групп в молекуле карбоновой кислоты определяет её основность. Кислоты, содержащие одну карбоксильную группу, являются одноосновными — это муравьиная, уксусная, акриловая, бензойная и другие кислоты.
Простейшим представителем двухосновных карбоновых кислот является щавелевая кислота:
Щавелевая кислота содержится в листьях щавеля и поэтому получила такое название.
Ароматической двухосновной карбоновой кислотой является терефталевая кислота:
Терефталевая кислота используется в производстве синтетического волокна лавсан (§ 38).
Примером трёхосновной кислоты является лимонная кислота:
Она содержится в лимонах.
Многие карбоновые кислоты присутствуют в продуктах природного происхождения, этим обусловлены и их названия (рис. 31.1). 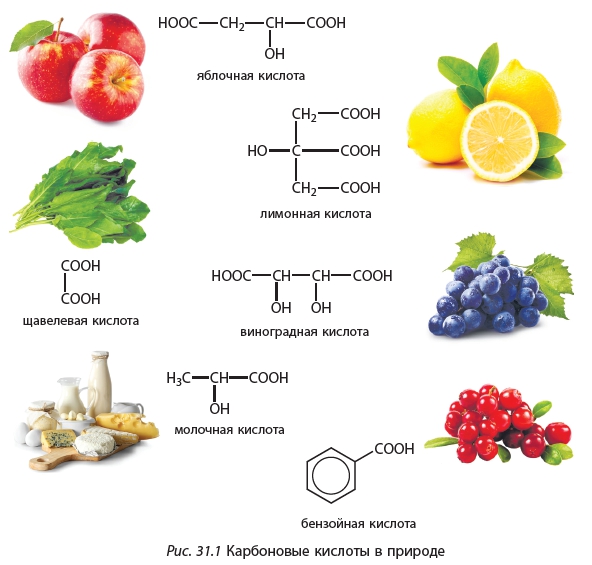
|
Карбоновые кислоты — органические соединения, молекулы которых содержат одну или несколько карбоксильных групп —СООН, соединённых с углеводородным радикалом или атомом водорода. Число карбоксильных групп в молекуле карбоновой кислоты определяет её основность. Общая формула гомологов уксусной кислоты СnH2n+1—COOH. Карбоновые кислоты могут быть насыщенными, ненасыщенными, ароматическими, одноосновными и многоосновными. |
Спирты и фенолы
Спирты – производные углеводородов, один или несколько атомов водорода в которых заменены на гидроксильную группу -OH. Спирты с одной гидроксильной группой называют одноатомными, с двумя – двухатомными, с тремя трехатомными и т.д. Например:
Спирты с двумя и более гидроксильными группами называют также многоатомными спиртами. Общая формула предельных одноатомных спиртов CnH2n+1OH или CnH2n+2O. Общая формула предельных многоатомных спиртов CnH2n+2Ox , где x – атомность спирта.
Спирты могут быть и ароматическими. Например:
бензиловый спирт
Общая формула таких одноатомных ароматических спиртов CnH2n-6O.
Однако, следует четко понимать, что производные ароматических углеводородов, в которых на гидроксильные группы заменены один или несколько атомов водорода при ароматическом ядре не относятся к спиртам. Их относят к классу фенолы. Например, это данное соединение является спиртом:
А это представляет собой фенол:
Причина, по которой фенолы не относят к спиртам, кроется в их специфических химических свойствах, сильно отличающих их от спиртов. Как легко заметить, однотомные фенолы изомерны одноатомным ароматическим спиртам, т.е. тоже имеют общую молекулярную формулу CnH2n-6O.
Понятие кислота
В 1877 году химик из Швеции Сванте Аррениус предложил разделять ряд веществ на основания и кислоты. Согласно его теории, если при растворении в воде элемент высвобождает протон водорода Н+, его нужно относить к кислоте, а если гидроксид-иона (ОН-), то к основанию. Это правило позволило объяснить нейтрализацию веществ при взаимодействии друг с другом. Позже учёный дал уточнение, что сталкивание гидроксид-иона с ионом водорода образовывает воду H2O.

В начале двадцатого века британец Томас Лаури и датчанин Йоханнсен Брёнстед расширили определение. Они предложили относить к кислотам любую молекулу (ион), способную отдавать протон. Это позволило описать реакции, проходящие c водой, например, хлорид аммония.
В 1923 году американец Льюис на основании двух определений сформулировал своё правило. Его формулировка и стала использоваться повсеместно. По нему, кислота — это химическое соединение, принимающее электронную пару и образовывающее ковалентную связь. Основание же, напротив — соединение, способное избавляться от электронной пары.
Все кислоты в химии принято разделять на 2 типа:
- Кислородосодержащие;
- Бескислородные.
Кроме этого, соединения могут быть одноосновными, двухосновными или трёхосновными. Все кислоты, за исключением кремниевой, отлично растворяются в воде. При взаимодействии с основаниями образуют соль, воду и кислотный остаток. Протекание реакции при соприкосновении с металлами происходит не всегда. Взаимодействие возможно лишь элементов, которые располагаются левее водорода. При этом кислотное соединение должно быть не только сильным, но и способным отдавать частицы водорода, которые выделяются во время взаимодействия.
Кислотные растворы могут изменять цвет. Так, лакмус становится красным. Соединение при взаимодействии имеет кислый вкус, появляется электрическая проводимость.
Определение
Карбоновые кислоты — это производные углеводородов, в молекулах которых содержится одна или несколько карбоксильных групп:
Карбоксильная группа имеет сложный состав. Она состоит из карбонильной и гидроксильной (гидроксо) групп:
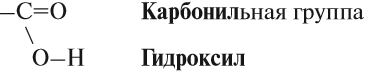
Карбоновые кислоты часто встречаются в природе, придавая ягодам и фруктам, а также некоторым другим продуктам питания кислый вкус. Их делят на различные группы (классы) по некоторым признакам:
По строению (составу) углеводородного радикала кислоты делят на:
– Предельные
в углеводородном радикале только простые связи;
– Непредельные (в углеводородном радикале есть кратная связь);
в углеводородном радикале есть кратная связь;
– Ароматические
имеется бензольное кольцо.
Задание 24.1. Определите состав этих кислот.
Для того чтобы различить по составу предельные и непредельные кислоты, нужно умножить на два число атомов углерода в углеводородном радикале и сравнить полученную величину (С) с числом атомов водорода (В) в углеводородном радикале:
- у предельных кислот В > C, например для С3Н7СООН: В = 7, а С = 3 · 2 = 6;
- у непредельных кислот B < C, например для С3Н5СООН: В = 5, а С = 3 · 2 = 6.
Задание 24.2. Какая из следующих кислот является предельной:
![]()
По числу карбоксильных групп кислоты делят на:
– Одноосновные
есть одна карбоксильная группа;
– Двухосновные
есть две карбоксильные группы.
Бывают кислоты, содержащие и большее число карбоксильных групп. Рассмотрим строение молекул и свойства карбоновых кислот на примере предельных одноосновных кислот.

Суточная норма, источники
Для сохранения кислотно – щелочного баланса в пределах нормы (рН 7,36 – 7,42) важно ежедневно употреблять продукты, содержащие органические кислоты. Для большинства овощей (огурцы, болгарский перец, капуста, лук репчатый) количество соединения на 100 грамм съедобной части составляет 0,1 – 0,3 грамма
Повышенное содержание полезных кислот в ревене (1 грамм), грунтовых томатах (0,8 грамма), щавеле (0,7 грамма), фруктовых соках, квасе, творожной сыворотке, кумысе, кислых сортах вин (до 0,6 грамм). Лидерами по уровню органических веществ выступают ягоды и фрукты:
Для большинства овощей (огурцы, болгарский перец, капуста, лук репчатый) количество соединения на 100 грамм съедобной части составляет 0,1 – 0,3 грамма. Повышенное содержание полезных кислот в ревене (1 грамм), грунтовых томатах (0,8 грамма), щавеле (0,7 грамма), фруктовых соках, квасе, творожной сыворотке, кумысе, кислых сортах вин (до 0,6 грамм). Лидерами по уровню органических веществ выступают ягоды и фрукты:
- лимон – 5,7 грамма на 100 грамм продукта;
- клюква – 3,1 грамма;
- красная смородина – 2,5 грамма;
- черная смородина – 2,3 грамма;
- рябина садовая – 2,2 грамма;
- вишня, гранат, мандарины, грейпфрут, земляника, рябина черноплодная – до 1,9 грамма;
- ананас, персики, виноград, айва, алыча – до 1,0 грамма.
До 0,5 грамм органических кислот содержат молоко, кисломолочные продукты. Их количество зависит от свежести и вида изделия. При длительном хранении происходит закисление такой продукции, в результате она становится непригодной к употреблению в диетическом питании. Учитывая, что каждый вид органической кислоты обладает особым действием, суточная надобность организма во многих из них варьируется в пределах от 0,3 до 70 грамм. При хронической усталости, пониженной секреции желудочного сока, авитаминозах потребность возрастает. При заболеваниях печени, почек, повышенной кислотности желудочного сока, наоборот, снижается. Показания к дополнительному приему природных органических кислот: низкая выносливость организма, хроническое недомогание, снижение тонуса скелетной мускулатуры, головные боли, фибромиалгия, спазмы в мышцах.


































