Кинетическая энергия движущейся частицы
Формула для кинетической энергии Ек движущегося со скоростью v тела массой m была получена в разделе механики. Это соотношение справедливо не только для поведения тел видимых размеров, но и для микрочастиц (молекул, атомов, электронов и т.п.):
$Ек = {m * v^2\over 2}$ (1),
Полная кинетическая энергию вещества Епк получается сложением энергий всех отдельных частиц:
$Е^п_к = Е_1+ Е_2 + Е_3 +…. Е_N$ (2),
где N — полное число частиц в веществе.
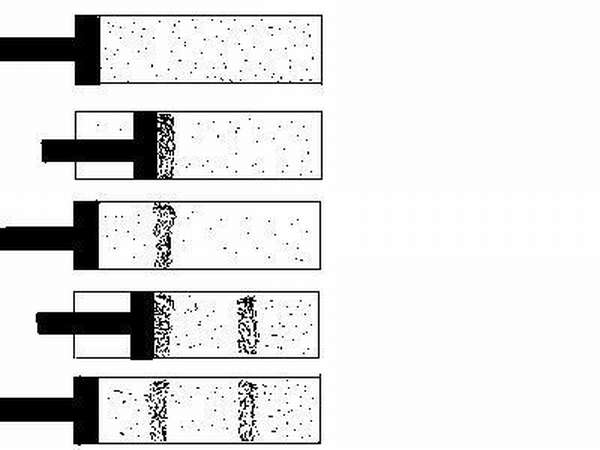
Рис. 1. Хаотически движущиеся с разными скоростями молекулы в веществе.
Найти суммарную кинетическую энергию всего вещества с помощью формул (1) и (2), конечно, невозможно: ведь для этого необходимо знать массы и скорости всех частиц, а также их общее количество. Если учесть, что только в одном моле вещества находится огромное число молекул (6,023*1023!), то становится понятно, что для решения этой задачи требуется другой подход.
Наблюдениями и исследованиями процессов передачи тепла ученые занимались задолго до нахождения формул молекулярно-кинетической теории. Для того чтобы придать понятиям “теплый”, “холодный” и т.п. более четкий, числовой вид, были изобретены термометры. Один из первых термометров придумал знаменитый Галилео Галилей, живший в Италии с 1564 г. по 1642 г.
Эксперименты показывали, что чем горячее вещество, тем быстрее (“энергичнее”) двигаются частицы. После изобретения микроскопа появилась возможность визуально наблюдать броуновское движение частиц, которые начинали перемещаться быстрее при нагревании.
Оказывается в 1 см3 при 0С и 760 мм.рт.ст. находится 2,7*1019 молекул. Чтобы ощутить насколько велико это число приведем такой пример. Предположим, что газ удаляется из крохотного сосуда объемом 1 см3 с такой скоростью, что в каждую секунду “убегает” миллион молекул. Нетрудно подсчитать, что сосуд опустеет через миллион лет!
Основы сохранения и превращения
 Из основ физики известно, что суммарная сила любого объекта, независимо от времени и места его пребывания, всегда остается величиной постоянной, преобразуются лишь ее постоянные составляющие (Еп) и (Ек).
Из основ физики известно, что суммарная сила любого объекта, независимо от времени и места его пребывания, всегда остается величиной постоянной, преобразуются лишь ее постоянные составляющие (Еп) и (Ек).
Переход потенциальной энергии в кинетическую и обратно происходит при определенных условиях.
Например, если предмет не перемещается, то его кинетическая энергия равна нулю, в его состоянии будет присутствовать только потенциальная составляющая.
И наоборот, чему равна потенциальная энергия объекта, например, когда он находится на поверхности Земли (h=0)? Конечно, она нулевая, а Е тела будет состоять только из ее составляющей Ек.
Но потенциальная энергия – это мощность движения. Стоит только системе приподняться на какую- то высоту, после чего его Еп сразу начнет увеличиваться, а Ек на такую величину, соответственно, уменьшаться. Эта закономерность просматривается в вышеуказанных формулах (1) и (2).
Для наглядности приведем пример с камнем либо мячом, которые подбрасывают. В процессе полета каждый из них обладает и как потенциальной, так и кинетической составляющей. Если одна увеличивается, то другая на такую же величину уменьшается.
Полет предметов вверх продолжается лишь до тех пор, пока хватит запаса и сил у составляющей движения Ек. Как только она иссякла, начинается падение.
 А вот чему равна потенциальная энергия предметов в самой верхней точке, догадаться нетрудно, она максимальная.
А вот чему равна потенциальная энергия предметов в самой верхней точке, догадаться нетрудно, она максимальная.
При их падении происходит все наоборот. При касании с землей уровень кинетической энергии равен максимуму.
Действие этого закона наблюдается не только в обычной жизни, но и в научных теориях. Кратко об одной из них.
Так как между многочисленными частицами идеального газа отсутствует какое-либо взаимодействие, то потенциальная составляющая описываемого явления молекул постоянно нулевая. Значит, вся внутренняя сила частиц идеального газа определяется, как средняя кинетическая, и рассчитывается по приведенной выше формуле (1).
Внимание! В наше время на письменных столах можно увидеть сувенир, называемый «маятником Ньютона». Этот прибор прекрасно демонстрирует процесс преобразования
Если крайний шарик отвести в сторону, а затем его отпустить, он после столкновения передает свой энергетический заряд следующему шарику, а тот своему соседу.
Виды энергии в физике
Кинетическая и потенциальная энергии, формулы
На вопрос, например, как найти кинетическую энергию, ученые давно дали ответ. Уже в середине XIX в. английский механик Уильям Томсон использовал в своих опытах определение «кинетическая». Но современная жизнь заставила проводить глубокие исследования по части преобразования одного вида в другой.
Основное уравнение МКТ
Основная задача молекулярно-кинетической теории газа заключается в том, чтобы установить соотношение между давлением газа и его микроскопическими параметрами: массой молекул, их средней скоростью и концентрацией. Это соотношение называется основным уравнением молекулярно-кинетической теории газа или кратко — основным уравнением МКТ.
В основе молекулярно-кинетической теории лежат три положения.
-
Все вещества образованы из мельчайших частиц — молекул, которые состоят из атомов.
Молекулы химического вещества могут быть простыми и сложными, то есть состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.
-
Атомы и молекулы находятся в непрерывном хаотическом движении.
-
Частицы взаимодействуют друг с другом силами, которые имеют электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
Мы уже выяснили, что причина давления газа на стенки — это удары молекул. Давление напрямую зависит от количества молекул — чем их больше, тем больше ударов о стенки и тем больше давление. А количество молекул в единице объема — это концентрация. Значит, давление газа зависит от концентрации.
Также давление пропорционально квадрату скорости, так как чем больше скорость молекулы, тем чаще она бьется о стенку сосуда. Расчеты показывают, что основное уравнение молекулярно-кинетической теории для идеального газа имеет следующий вид.
|
Основное уравнение МКТ p = nkT или p — давление газа n — концентрация T — температура газа m — масса одной молекулы v — средняя квадратичная скорость [м/с] |
Коэффициент 1/3 обусловлен трехмерностью пространства: во время хаотического движения молекул все три направления равноправны.
Важный нюанс: средняя квадратичная скорость сама по себе не в квадрате! Ее формула указана выше, а в основном уравнении МКТ (да и не только в нем) она возведена в квадрат. Это значит, что формулу средней квадратичной скорости нужно подставлять не вместо v2, а вместо v — и потом уже возводить эту формулу в квадрат. Это часто провоцирует путаницу.
Мы знаем, что кинетическая энергия вычисляется по следующей формуле:
|
Кинетическая энергия Ек = mv2/2 Ек — кинетическая энергия m — масса тела v — скорость [м/с] |
Для молекулы газа формула примет вид:
|
Средняя кинетическая энергия поступательного движения молекулы Ек = mv2/2 Ек — средняя кинетическая энергия поступательного движения молекулы m — масса молекулы v — скорость молекулы [м/с] |
Из этой формулы можно выразить mv2 и подставить в основное уравнение МКТ. Подставим и получим, что давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы.
|
Основное уравнение МКТ p — давление газа n — концентрация E — средняя кинетическая энергия поступательного движения молекулы |
Второй закон термодинамики
Все процессы в природе протекают только в одном направлении. В обратном направлении самопроизвольно они протекать не могут. Необратимым называется процесс, обратный которому может протекать только как составляющая более сложного процесса.
Примеры необратимых процессов:
- переход тепла от более нагретого тела к менее нагретому телу;
- переход механической энергии во внутреннюю энергию.
Первый закон термодинамики ничего не говорит о направлении процессов в природе.
Второй закон термодинамики выражает необратимость процессов, происходящих в природе. Существует несколько его формулировок.
Второй закон термодинамики (формулировка Клаузиуса):
невозможно перевести тепло от более холодной системы к более горячей при отсутствии одновременных изменений в обеих системах или окружающих телах.
Второй закон термодинамики (формулировка Кельвина):
невозможно осуществить такой периодический процесс, единственным результатом которого было бы получение работы за счет теплоты, взятой от одного источника.
Эта формулировка говорит также и о том, что невозможно построить вечный двигатель второго рода, то есть двигатель, совершающий работу за счет охлаждения какого-либо одного тела.
Важно!
В формулировке второго закона термодинамики большое значение имеют слова «единственным результатом». Если процессы, о которых идет речь, не являются единственными, то запреты снимаются
Например, в холодильнике происходит передача тепла от более холодного тела к нагретому и при этом осуществляется компенсирующий процесс превращения механической энергии окружающих тел во внутреннюю энергию.
Второй закон термодинамики выполняется для систем с огромным числом частиц. В системах с малым количеством частиц возможны флуктуации – отклонения от равновесия.
Энергия движения

Кинетическая энергия тела — это та, которой тело обладает благодаря своему движению. Её определяют как силу, необходимую для ускорения тела определённой массы от покоя до максимальной указанной скорости. Как только достигается ускорение, тело сохраняет энергию, если скорость не изменяется. Чтобы тело вернулось в состояние покоя, необходима отрицательная работа той же величины.
Единица измерения кинетической энергии — джоуль. Обычно она обозначается буквой E c или E k. Расчёт мощности измеряется по-разному. Для того чтобы найти её количество можно использовать онлайн-калькулятор.
История и определение

Прилагательное «кинетический» в названии произошло от древнегреческого слова кίνησις kinēsis, что означает «движение».
Идею связи классической механики и кинематической энергии впервые выдвинули Готфрид Вильгельм Лейбниц и Даниэль Бернулли. Учёный Грейвсанд из Нидерландов предоставил экспериментальное подтверждение этой связи.
Но первые теоретические выкладки этих идей приписаны Гаспар-Гюстав Кориолису, который в 1829 году опубликовал статью, где была изложена математика этого процесса. Сам термин появился в 1849 году благодаря Уильяму Томсону, более известному как лорд Кельвин.
Теорема о кинетической энергии гласит: изменение кинетической силы тела равно работе равнодействующей всех сил, действующих на тело. Эта теорема справедлива независимо от того, какие силы действуют на тело.
Часто различают кинетическую силу поступательного и вращательного движения. Как и любая физическая величина, которая является функцией скорости, она не только зависит от внутренней природы этого объекта, но также зависит от отношений между объектом и наблюдателем (в физике наблюдатель формально определяется классом определённая система координат, называемая инерциальной системой отсчёта).
Эта энергия деградирует и сохраняется в каждой трансформации, теряя способность совершать новые трансформации, но она не может быть создана или разрушена, только трансформирована, поэтому её сумма во вселенной всегда постоянна.
Кинематика системы частиц
Для частицы или для твёрдого тела, которое не вращается, кинетическая энергия падает до нуля, когда тело останавливается. Однако для систем, которые содержат много частиц с независимыми движениями, это не совсем верно.
Для твёрдого тела, которое вращается, полная кинетическая сила может быть разбита на две суммы: энергия перемещения, связанная со смещением центра масс тела в пространстве, и вращения (с вращательным движением с определённой угловой скоростью).
Примеры проявления потенциальной и кинетической энергии
Кинетическая энергия представляет собой энергию движения тела. Простейшим примером такой энергии является пуля, которая обладает определенной массой и перемещается с некой скоростью. При столкновении с твердым телом пуля может изменить его положение или деформировать. Другие примеры кинетической энергии:
- движущийся автомобиль;
- бегущий человек;
- катящийся шарик;
- закрывающееся окно;
- перемещающийся электрический заряд в виде электрона.
Потенциальная энергия является энергией, которая описывает взаимодействие тел. К примеру, для растущего на дереве яблока можно определить нулевой уровень энергии на земле. В результате падения яблоко может каким-либо образом деформировать поверхность земли. Другие примеры потенциальной энергии:
- сидящий на стуле человек;
- неподвижная бетонная плита, которую поднял строительный кран;
- поднятый над землей мячик;
- река, закрытая дамбой.
Заметим, что в предыдущем примере, чем выше яблоко висит, тем сильнее оно упадет. Ключевым моментом является увеличение скорости яблока в момент падения и уменьшение высоты. Это закон сохранения энергии. В результате падения, высота и скорость яблока будут равны нулю, а энергия расходуется на совершении работы в виде деформации и нагревания земли. Таким образом, проявляется закон изменения энергии.
Рассмотренные понятия кинетической и потенциальной энергии часто используют при решении задач.
Что такое кинетическая энергия
Кинетическая энергия – это энергия, создаваемая движущимся телом. На греческом языке кинетика означает «движение», в то время как энергия означает «работа». Другими словами, кинетическая энергия – это работа, которую тело выполняет, когда оно движется.
Мы можем воспользоваться кинетической энергией многих природных явлений. Например, движение воды в реке превращается в электричество благодаря электростанциям. Энергия ветра – это кинетическая энергия воздуха. Когда мы прибиваем гвоздь молотком, мы используем кинетическую энергию молотка при его перемещении.
Кинетическая энергия в физике измеряется в джоулях , сокращенно буквой J.
Формула кинетической энергии
Для расчета кинетической энергии тел используется уравнение:
Это означает, что кинетическая энергия Ec равна массе тела m, умноженной на квадрат скорости v, делённые на 2.
Мы можем сделать вывод, что чем больше масса, тем больше энергия, и что энергия пропорциональна скорости, умноженной на себя.
Кинетическая энергия не является вектором. Это означает, что если вы бросаете шар со скоростью 5 м / с, шар будет иметь одинаковую кинетическую энергию, независимо от того, бросаете ли вы его влево или вправо или вверх.
Кинетическая энергия зависит от массы и скорости
 Гоночные машины спроектированы с наименьшей массой для улучшения характеристик.
Гоночные машины спроектированы с наименьшей массой для улучшения характеристик.
Кинетическая энергия зависит от массы и скорости тела. Это означает, что чем больше или быстрее объект, тем больше энергии он производит.
Примером вышесказанного может быть следующее: грузовик больше, чем автомобиль; Если оба едут с одинаковой скоростью и врезаются в стену, урон, нанесенный грузовиком, будет больше. В этом случае грузовик обладает большей кинетической энергией.
А теперь представьте: две одинаковые машины едут, одна со скоростью 50 км / ч, а другая со скоростью 100 км / ч. Чем выше скорость, тем серьезнее авария.
Таким образом, кинетическая энергия зависит от квадрата скорости. Это означает, что когда скорость объекта удваивается, его кинетическая энергия увеличивается в четыре раза.
Автомобиль, движущийся со скоростью 60 км / ч, имеет в четыре раза больше кинетической энергии, чем автомобиль, движущийся со скоростью 30 км / ч, и, следовательно, в четыре раза больший потенциал разрушения в случае аварии.
Как рассчитать кинетическую энергию тела?
В аэропорту хотят рассчитать кинетическую энергию 30-килограммовой упаковки в системе, которая движется со скоростью 0,500 м / с. Как мы это делаем?
- Мы знаем массу и скорость упаковки, поэтому используем формулу:
- Подставляя значения, имеем:
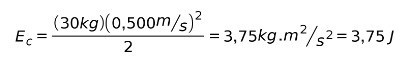
Рассуждение
Единицей кинетической энергии является джоуль, которая является той же для единицы работы
Обратите внимание, что, несмотря на то, что он тяжелый, его кинетическая энергия не так велика из-за его низкой скорости
Ключевые моменты для запоминания
- Тело имеет кинетическую энергию, только если оно находится в движении.
- Кинетическая энергия зависит от массы и скорости тела.
Задача 1 на нахождение кинетической энергии
Слон в 6000 кг бежит со скоростью 10 м / с. Какова его кинетическая энергия? Какова скорость пушечного ядра весом 1 кг, если у него была та же самая кинетическая энергия слона?
Ответ
Используя уравнение кинетической энергии, энергия слона равна:
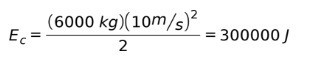
Рассчитав кинетическую энергию, мы можем получить скорость пули, очистив v:

Это означает, что скорость пули равна 775 м / с. Сравните это со скоростью слона: вот это разница!
Задача 2
Мужчина врезался в столб на своей машине. Когда он пошел, чтобы сообщить о катастрофе, он сказал, что ехал с допустимой скоростью во время аварии.
Но следователь помнил физику 7 и 8 класса и установил, что скорость транспортного средства была в два раза выше, чем утверждал водитель.
Какова взаимосвязь между кинетической энергией и скоростью, сообщаемой человеком, и кинетической энергией со скоростью, рассчитанной следователем?
Мы будем рассматривать Ec1 как кинетическую энергию транспортного средства на скорости v1, сообщаемой человеком, и Ec2 как кинетическую энергию со значением скорости v2, рассчитанным исследователем. Соотношение между кинетическими энергиями рассчитывается путем деления энергий следующим образом:
- Следователь сказал, что скорость во время аварии была вдвое выше, чем сообщал человек, то есть:
- Подставим значение скорости в уравнение:
Исключая похожие термины, мы имеем:
Это означает, что кинетическая энергия в соответствии со скоростью, сообщаемой человеком, составляет четверть кинетической энергии по расчетам следователя. Проще говоря, ущерб, нанесенный автомобилем, был в четыре раза больше, чем сообщал мужчина.
Температура
Самый простой способ изменить скорость реакции – изменить температуру. Как вам, должно быть, известно из курса физики, температура – это мера средней кинетической энергии движения частиц вещества. Если мы повышаем температуру, то частицы любого вещества начинают двигаться быстрее, а следовательно, сталкиваться чаще.
Однако при повышении температуры скорость химических реакций увеличивается в основном благодаря тому, что увеличивается число эффективных соударений. При повышении температуры резко увеличивается число активных частиц, которые могут преодолеть энергетический барьер реакции. Если понижаем температуру – частицы начинают двигаться медленнее, число активных частиц уменьшается, и количество эффективных соударений в секунду уменьшается. Таким образом, при повышении температуры скорость химической реакции повышается, а при понижении температуры — уменьшается.
Обратите внимание! Это правило работает одинаково для всех химических реакций (в том числе для экзотермических и эндотермических). Скорость реакции не зависит от теплового эффекта
Скорость экзотермических реакций при повышении температуры возрастает, а при понижении температуры – уменьшается. Скорость эндотермических реакций также возрастает при повышении температуры, и уменьшается при понижении температуры.
Более того, еще в XIX веке голландский физик Вант-Гофф экспериментально установил, что скорость большинства реакций примерно одинаково изменяется (примерно в 2-4 раза) при изменении температуры на 10оС.
Правило Вант-Гоффа звучит так: повышение температуры на 10оС приводит к увеличению скорости химической реакции в 2-4 раза (эту величину называют температурный коэффициент скорости химической реакции γ).
Точное значение температурного коэффициента определяется для каждой реакции.
здесь v2 — скорость реакции при температуре T2,
v1 — скорость реакции при температуре T1,
γ — температурный коэффициент скорости реакции, коэффициент Вант-Гоффа.
В некоторых ситуациях повысить скорость реакции с помощью температуры не всегда удается, т.к. некоторые вещества разлагаются при повышении температуры, некоторые вещества или растворители испаряются при повышенной температуре, т.е. нарушаются условия проведения процесса.
2. Концентрация
Также изменить число эффективных соударений можно, изменив концентрацию реагирующих веществ. Понятие концентрации, как правило, используется для газов и жидкостей, т.к. в газах и жидкостях частицы быстро двигаются и активно перемешиваются. Чем больше концентрация реагирующих веществ (жидкостей, газов), тем больше число эффективных соударений, и тем выше скорость химической реакции.
На основании большого числа экспериментов в 1867 году в работах норвежских ученых П. Гульденберга и П. Вааге и, независимо от них, в 1865 году русским ученым Н.И. Бекетовым был выведен основной закон химической кинетики, устанавливающий зависимость скорости химической реакции от концентрации реагирующих веществ:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их коэффициентам в уравнении химической реакции.
Для химической реакции вида: aA + bB = cC + dD закон действующих масс записывается так:
здесь v — скорость химической реакции,
CA и CB — концентрации веществ А и В, соответственно, моль/л
k – коэффициент пропорциональности, константа скорости реакции.
Например, для реакции образования аммиака:
N2 + 3H2 2NH3
закон действующих масс выглядит так:
Константа скорости реакции k показывает, с какой скоростью будут реагировать вещества, если их концентрации равны 1 моль/л, или их произведение равно 1. Константа скорости химической реакции зависит от температуры и не зависит от концентрации реагирующих веществ.
В законе действующих масс не учитываются концентрации твердых веществ, т.к. они реагируют, как правило, на поверхности, и количество реагирующих частиц на единицу поверхности при этом не меняется.
В большинстве случаев химическая реакция состоит из нескольких простых этапов, в таком случае уравнение химической реакции показывает лишь суммарное или итоговое уравнение происходящих процессов. При этом скорость химической реакции сложным образом зависит (или не зависит) от концентрации реагирующих веществ, полупродуктов или катализатора, поэтому точная форма кинетического уравнения определяется экспериментально, или на основании анализа предполагаемого механизма реакции. Как правило, скорость сложной химической реакции определяется скоростью его самого медленного этапа (лимитирующей стадии).
Хранение и транспортировка газов
Если нужно перевезти значительное количество газа из одного места в другое или если газ необходимо длительно хранить, его помещают в специальные прочные металлические сосуды. Из-за того, что при уменьшении объема увеличивается давление, газ можно закачать в небольшой баллон, но он должен быть очень прочным.
Сосуды, предназначенные для транспортировки газов, выдерживают высокие давления. Поэтому с помощью специальных насосов (компрессоров) туда можно закачать значительные массы газа, которые в обычных условиях занимали бы в сотни раз больший объем.
Поскольку давление газов в баллонах даже при комнатной температуре очень велико, их ни в коем случае нельзя нагревать. Например, держать под прямыми лучами солнца или пытаться сделать в них отверстие — даже после использования.
Основные теоретические сведения
Механическая работа
Энергетические характеристики движения вводятся на основе понятия механической работы или работы силы. Работой, совершаемой постоянной силой F, называется физическая величина, равная произведению модулей силы и перемещения, умноженному на косинус угла между векторами силы F и перемещения S:
Как успешно подготовиться к ЦТ по физике и математике?
Для того чтобы успешно подготовиться к ЦТ по физике и математике, среди прочего, необходимо выполнить три важнейших условия:
Успешное, старательное и ответственное выполнение этих трех пунктов позволит Вам показать на ЦТ отличный результат, максимальный из того на что Вы способны.
Нашли ошибку?
ЗАПРЕЩЕНО использование представленных на сайте материалов или их частей в любых коммерческих целях, а также их распространение, перепечатка или воспроизведение в любой форме. Нарушение прав правообладателей преследуется по закону.
Проблемы энергетики и охрана окружающей среды
Тепловые двигатели широко применяются на транспорте и в энергетике (тепловые и атомные электростанции). Использование тепловых двигателей сильно влияет на состояние биосферы Земли. Можно выделить следующие вредные факторы:
- при сжигании топлива используется кислород из атмосферы, что приводит к снижению содержания кислорода в воздухе;
- при сгорании топлива в атмосферу выделяется углекислый газ. Концентрация углекислого газа в атмосфере повышается. Это изменяет прозрачность атмосферы, так как молекулы углекислого газа поглощают инфракрасное излучение, что ведет к повышению температуры (парниковый эффект);
- при сжигании угля в атмосферу поступают азотные, серные соединения и соединения свинца, вредные для здоровья человека.
Решение проблемы охраны окружающей среды от вредного воздействия предприятий тепловой энергетики требует комплексного подхода. Массовыми загрязнителями при работе тепловых электростанций являются летучая зола, диоксид серы и оксиды азота. Методы сокращения выбросов зависят от свойств топлива и условия его сжижения. Предотвращение загрязнения летучей золой достигается очисткой всего объема продуктов сгорания твердого топлива в высокоэффективных золоуловителях. Сокращение выбросов оксидов азота с продуктами сгорания топлива на тепловых электростанциях, а также в парогазовых и газотурбинных установках обеспечивается, главным образом, технологией сжигания топлива. Уменьшение выброса диоксида серы может быть достигнуто различными методами облагораживания и переработки топлива вне тепловых электростанций либо непосредственно на тепловых электростанциях, а также очисткой дымовых газов.
Контроль за выбросом вредных веществ электростанций осуществляется специальными приборами.
В ряде случаев достаточно эффективным решением вопросов очистки выбросов в атмосферу остается сооружение фильтров-уловителей и дымовых труб. У дымовой трубы два назначения: первое — создавать тягу и тем самым заставлять воздух — обязательный участник процесса горения — в нужном количестве и с должной скоростью входить в топку; второе — отводить продукты горения (вредные газы и имеющиеся в дыме твердые частицы) в верхние слои атмосферы. Благодаря непрерывному турбулентному движению вредные газы и твердые частицы уносятся далеко от источника их возникновения и рассеиваются.
Для рассеивания сернистого ангидрида, содержащегося в дымовых трубах тепловых электростанций, сооружаются дымовые трубы высотой 180, 250 и 320 м. Тепловые электростанции России, работающие на твердом топливе, за год выбрасывают в отвалы около 100 млн т золы и шлаков. Зола и шлаки занимают большие площади земель, неблагоприятно влияют на окружающую среду.
Более половины всех загрязнений создает транспорт. Один из путей решения проблемы защиты окружающей среды заключается в переходе на дизельные двигатели, электродвигатели, повышение КПД.
Алгоритм решения задач раздела «Термодинамика»:
- выделить систему тел и определить ее тип (замкнутая, адиабатически замкнутая, замкнутая в механическом смысле, незамкнутая);
- выяснить, как изменяются параметры состояния \( (p,V,T) \) и внутренняя энергия каждого тела системы при переходе из одного состояния в другое;
- записать уравнения, связывающие параметры двух состояний системы, формулы для расчета изменения внутренней энергии каждого тела системы при переходе из одного состояния в другое;
- определить изменение механической энергии системы и работу внешних сил по изменению ее объема;
- записать формулу первого закона термодинамики или закона сохранения и превращения энергии;
- решить систему уравнений относительно искомой величины;
- проверить решение.
Основные формулы раздела «Термодинамика»


ФИЗИКА
§ 4.5. Температура — Мера средней кинетической энергии молекул
Из основного уравнения молекулярно-кинетической теории газа вытекает важное следствие: температура есть мера средней кинетической энергии молекул. Докажем это.. Для простоты будем считать количество газа равным 1 моль
Молярный объем газа обозначим через VM. Произведение молярного объема на концентрацию молекул представляет собой постоянную Авогадро NA, т. е. число молекул в 1 моль
Для простоты будем считать количество газа равным 1 моль. Молярный объем газа обозначим через VM. Произведение молярного объема на концентрацию молекул представляет собой постоянную Авогадро NA, т. е. число молекул в 1 моль.
Умножим обе части уравнения (4.4.10) на молярный объем VM и учтем, что nVM = NA. Тогда
![]()
Формула (4.5.1) устанавливает связь макроскопических параметров — давления р и объема VM — со средней кинетической энергией поступательного движения молекул.
Вместе с тем полученное опытным путем уравнение состояния идеального газа для 1 моль имеет вид
![]()
Левые части уравнений (4.5.1) и (4.5.2) одинаковы, значит, должны быть равны и их правые части, т.е.
Отсюда вытекает связь между средней кинетической энергией поступательного движения молекул и температурой:
![]()
Средняя кинетическая энергия хаотического движения молекул газа пропорциональна абсолютной температуре. Чем выше температура, тем быстрее движутся молекулы.
Соотношение между температурой и средней кинетической энергией поступательного движения молекул (4.5.3) установлено для разреженных газов. Однако оно оказывается справедливым для любых веществ, движение атомов или молекул которых подчиняется законам механики Ньютона. Оно верно для жидкостей, а также для твердых тел, у которых атомы могут лишь колебаться возле положений равновесия в узлах кристаллической решетки.
При приближении температуры к абсолютному нулю энергия теплового движения молекул также приближается к нулю(1).
Постоянная Больцмана
В уравнение (4.5.3) входит отношение универсальной газовой постоянной R к постоянной Авогадро NА. Это отношение одинаково для всех веществ. Оно называется постоянной Больцмана, в честь Л. Больцмана, одного из основателей молекулярно-кинетической теории.
Больцман Людвиг (1844—1906) — великий австрийский физик, один из основоположников молекулярно-кинетической теории. В трудах Больцмана молекулярно-кинетическая теория впервые предстала как логически стройная, последовательная физическая теория. Больцман дал статистическое истолкование второго закона термодинамики. Им много сделано для развития и популяризации теории электромагнитного поля Максвелла. Борец по натуре, Больцман страстно отстаивал необходимость молекулярного истолкования тепловых явлений и принял на себя основную тяжесть борьбы с учеными, отрицавшими существование молекул.
Постоянная Больцмана равна
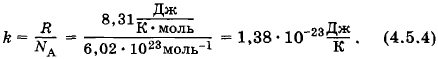
Уравнение (4.5.3) с учетом постоянной Больцмана записывается так:

Физический смысл постоянной Больцмана
Исторически температура была впервые введена как термодинамическая величина, и для нее была установлена единица измерения — градус (см. § 3.2). После установления связи температуры со средней кинетической энергией молекул стало очевидным, что температуру можно определять как среднюю кинетическую энергию молекул и выражать ее в джоулях или эргах, т. е. вместо величины Т ввести величину Т* так, чтобы
Определенная таким образом температура связана с температурой, выражаемой в градусах, следующим образом:
Поэтому постоянную Больцмана можно рассматривать как величину, связывающую температуру, выражаемую в энергетических единицах, с температурой, выраженной в градусах.
Зависимость давления газа от концентрации его молекул и температуры
Выразив из соотношения (4.5.5) и подставив в формулу (4.4.10), получим выражение, показывающее зависимость давления газа от концентрации молекул и температуры:
Из формулы (4.5.6) вытекает, что при одинаковых давлениях и температурах концентрация молекул у всех газов одна и та же.
Отсюда следует закон Авогадро: в равных объемах газов при одинаковых температурах и давлениях содержится одинаковое число молекул.
Средняя кинетическая энергия поступательного движения молекул прямо пропорциональна абсолютной температуре. Коэффициент пропорциональности — постоянную Болъцмана k ≈ 1023 Дж/К — надо запомнить.
(1) При очень низких температурах (вблизи абсолютного нуля) движение атомов и молекул уже не подчиняется законам Ньютона. Согласно более точным законам движения микрочастиц — законам квантовой механики — абсолютный нуль соответствует минимальному значению энергии движения, а не полному прекращению какого-либо движения вообще.
Газы реальные и идеальные

Газовое состояние материи представляет собой одно из существующих четырех агрегатных состояний вещества. Примерами чистых газов являются водород и кислород. Газы могут смешиваться друг с другом в произвольных пропорциях. Всем известный пример смеси — воздух. Названные газы являются реальными, однако при определенных условиях они могут считаться идеальными. Идеальным считается газ, который соответствует следующим характеристикам:
- Частицы, образующие его, не взаимодействуют друг с другом.
- Столкновения между отдельными частицами и между частицами и стенками сосудов носят абсолютно упругий характер, то есть количество движения и кинетическая энергия до и после столкновения сохраняется.
- Частицы не обладают объемом, но имеют некоторую массу.
Все реальные газы при температурах порядка и выше комнатной (больше 300 К) и при давлениях порядка и ниже одной атмосферы (105 Па) можно считать идеальными.


































