Эксперимент
А теперь сами убедимся в том, что масса сохраняется. В ходе эксперимента следует соблюдать аккуратность, вся посуда должна быть одноразовой и утилизироваться после проведения эксперимента.
Материалы и оборудование Два 90-миллилитровых картонных стаканчика Мерные ложки Водопроводная вода Одна столовая ложка (5 миллилитров) аптечного сульфата магния Ложка Жидкий школьный клей Кухонные весы Бумажное полотенце
Ход эксперимента 1. В один из картонных стаканчиков добавьте 2 столовые ложки (10 миллилитров) водопроводной воды и сульфат магния. Перемешивайте до тех пор, пока сульфат магния не растворится или полностью, или по крайней мере его осадок будет небольшим.
2. Во второй стаканчик влейте 1 столовую ложку (5 миллилитров) жидкого школьного клея.
3. Взвесьте оба стаканчика на весах. Запишите массу каждого стаканчика и их общую массу
Обратите внимание на внешний вид содержимого каждого из стаканчиков
4. Влейте водный раствор сульфата магния в стаканчик с клеем. Перемешайте содержимое стаканчика
Обратите внимание на его внешний вид
5. Взвесьте пустой стаканчик и стаканчик с раствором. Запишите массу каждого из них по отдельности и общую массу. Сравните общую массу с той, которая была при предыдущем взвешивании.
6. Теперь, сопоставив массы, извлеките лопаткой белый сгусток твердого вещества, который образовался в стаканчике и переместите его на бумажное полотенце. Оберните полотенце вокруг сгустка и сожмите его, чтобы выжать лишнюю жидкость. Чем отличается сгусток от тех веществ, которыми он был образован?
Результат Вначале один из стаканчиков содержит прозрачную жидкость, образованную сульфатом магния и водой, а второй — белый жидкий клей. После смешивания образуется белый твердый сгусток и некоторый излишек жидкости. Массы стаканчиков остаются прежними до и после смешивания.
Почему так происходит? Смесь сульфата магния и воды формирует раствор (вещество, растворенное в жидкости). Жидкий клей тоже является раствором, состоящим из различных веществ, растворенных в воде. Когда эти два раствора соединяются, происходит химическая реакция между ее компонентами, которая ведет к образованию белого твердого материала.
Даже когда исходные реагенты распадаются на частицы и переформируются в новом порядке, все они остаются в стаканчике. По этой причине, когда вы повторно взвешиваете стаканчики, не происходит никаких изменений в их общей массе. На этом простом примере продемонстрировано сохранение массы в ходе химической реакции.
Загадок энергии немало, читайте дополнительные материалы о них в соответствующей рубрике, которая будет пополняться по мере рассмотрения все новых и новых вопросов, касающихся энергии.
Молярная концентрация
Молярная концентрация (молярность)Сm выражает концентрацию вещества в растворе.
где νр.в. – количество растворенного вещества (моль),
Vр-ра– объем раствора (л).
Молярная концентрация измеряется в моль/л или М.
Задача. В 100 мл раствора содержится 1,8 г соляной кислоты.Чему равна молярная концентрация кислоты.
Найти количество вещества.
ν(HCl) = m (HCl) / M (HCl) = 1,8 г/ 36,5 г/моль = 0,05 моль
Найти молярную концентрацию раствора.
Сm (HCl) = ν (HCl) /Vр-ра= 0,05 моль / 0,1 л = 0,5 моль/л
Знание химических законов и формул позволяет работникам лабораторий делать растворы нужные растворы. Не на каждом производстве есть растворы всех концентраций, поэтому умение решать подобные задачи позволяет создавать необходимые смеси. На понятиях массовая доля и концентрация строится химия реальных систем.
Как этот закон применяется в химическом уравнении?
Закон сохранения массы имеет трансцендентное значение в стехиометрии, определяя последнее как вычисление количественных соотношений между реагентами и продуктами, присутствующими в химической реакции..
Принципы стехиометрии были провозглашены в 1792 году Иеремием Бенджамином Рихтером (1762-1807), который определил его как науку, которая измеряет количественные пропорции или массовые отношения химических элементов, которые участвуют в реакции.
В химической реакции происходит изменение веществ, которые вмешиваются в него. Наблюдается, что реагенты или реагенты потребляются для получения продуктов.
Во время химической реакции происходят разрывы связей между атомами, а также образование новых связей; но число атомов, участвующих в реакции, остается неизменным. Это то, что известно как закон сохранения материи.
Основные принципы
Этот закон предполагает два основных принципа:
-Общее количество атомов каждого типа одинаково в реагентах (до реакции) и в продуктах (после реакции).
-Общая сумма электрических зарядов до и после реакции остается постоянной.
Это потому, что число субатомных частиц остается постоянным. Эти частицы представляют собой нейтроны без электрического заряда, протоны с положительным зарядом (+) и электроны с отрицательным зарядом (-). Таким образом, электрический заряд не меняется во время реакции.
Химическое уравнение
Сказав вышесказанное, при представлении химической реакции с помощью уравнения (например, основного изображения) необходимо соблюдать основные принципы. Химическое уравнение использует символы или представления различных элементов или атомов, и как они сгруппированы в молекулы до или после реакции.
Следующее уравнение будет использоваться снова в качестве примера:
А + Б2 => AB2
Индекс представляет собой число, которое находится на правой стороне элементов (B2 и AB2) в его нижней части, указывая количество атомов элемента, присутствующего в молекуле. Это число нельзя изменить без производства новой молекулы, отличной от оригинальной.
Стехиометрический коэффициент (1, в случае А и остальных видов) представляет собой число, которое помещается в левую часть атомов или молекул, и указывает на их число, участвующее в реакции..
В химическом уравнении, если реакция необратима, ставится одна стрелка, указывающая направление реакции. Если реакция обратима, есть две стрелки в противоположном направлении. Слева от стрелок находятся реагенты или реагенты (А и В2), а справа — продукты (AB2).
качалки
Уравновешивание химического уравнения — это процедура, которая позволяет уравнять количество атомов химических элементов, присутствующих в реагентах, с количеством продуктов..
Другими словами, количество атомов каждого элемента должно быть одинаковым на стороне реагентов (перед стрелкой) и на стороне продукта реакции (после стрелки).
Говорят, что когда реакция сбалансирована, закон массового действия соблюдается.
Поэтому важно сбалансировать число атомов и электрических зарядов по обеим сторонам стрелки в химическом уравнении. Также сумма масс реагентов должна быть равна сумме масс продуктов
В случае представленного уравнения оно уже сбалансировано (равное количество A и B по обе стороны стрелки).
Что такое закон сохранения материи или массы?
Этот закон гласит, что в результате химической реакции масса реагентов равна массе продуктов. Закон выражается фразой «материя не создается и не разрушается, все преображается», как это было сформулировано Юлием фон Майером (1814-1878)..
Закон был составлен независимо Михаилом Ламаносовым в 1745 году и Антуаном Лавуазье в 1785 году. Хотя исследования Ламаносова по Закону о сохранении массы предшествуют исследованиям Лавуазье, они не были известны в Европе. за то, что написано на русском.
Эксперименты, проведенные в 1676 году Робертом Бойлом, привели их к выводу, что когда материал сжигался в открытом контейнере, материал увеличивал свой вес; возможно, из-за трансформации, пережитой самим материалом.
Эксперименты Лавуазера по сжиганию материалов в контейнерах с ограниченным потреблением воздуха показали увеличение веса. Этот результат соответствовал полученному Бойлем.
Вклад Лавуазье
Однако вывод Лавуазье был другим. Он полагал, что во время сжигания из воздуха извлекается масса, что объясняет увеличение массы, которое наблюдается в материалах, подвергаемых сжиганию..
Лавуазер считал, что масса металлов оставалась постоянной во время сжигания, и что уменьшение сжигания в закрытых контейнерах не было вызвано уменьшением фложисто (концепция неиспользования), предполагаемая сущность, связанная с производством тепла.
Лавойзер отметил, что наблюдаемое снижение было вызвано, скорее, снижением концентрации газов в закрытых контейнерах.
История открытия

Впервые о принципе сохранения материи люди задумывались еще в древности. Об этом рассуждали древние философы:
- Эмпедокл;
- Аристотель;
- Демокрит;
- Эпикур.
В 1673 году Роберт Бойль выразил сомнения в законе. У него при нагревании металлов вес окалины увеличился. Причиной этого было проведение опытов в открытых сосудах.

Закон сохранения веществ Ломоносов сформулировал на основании философских соображений. Великий ученый не считал, что открыл новую закономерность. Но ученый опирался на это правило в экспериментах.
Параллельно с Михаилом Васильевичем французский ученый Лавуазье занимался этим вопросом. И в 1789 году он провел опыты, доказывающие, что масса металлов в закрытых сосудах остается неизменной. Лавуазье и Ломоносов являются авторами этой закономерности.
Ссылки [ править ]
- ↑ Волькенштейн, Михаил В. (2009). Энтропия и информация (иллюстрированное изд.). Springer Science & Business Media . п. 20. ISBN 978-3-0346-0078-1. Отрывок страницы 20
- ^ Окунь Лев Борисович (2009). Энергия и масса в теории относительности . World Scientific . п. 253. ISBN. 978-981-281-412-8. Выдержка страницы 253
- ^ Льюис, Дэвид (2012). Ранние русские химики-органики и их наследие (иллюстрированное изд.). Springer Science & Business Media. п. 29. ISBN 978-3-642-28219-5. Отрывок страницы 29
- ^ Пт. 12; см. стр. 291–2 Kirk, GS; JE Raven; Малкольм Шофилд (1983). Досократические философы (2-е изд.). Кембридж: Издательство Кембриджского университета . ISBN 978-0-521-27455-5.
- ^ Лонг, AA; Д. Н. Седли (1987). «Эпикуреизм: принципы сохранения». Философы эллинизма. Том 1: Переводы основных источников с философскими комментариями . Кембридж: Издательство Кембриджского университета. С. 25–26. ISBN 978-0-521-27556-9.
- ↑ Махавира датируется 598 г. до н.э. — 526 г. до н.э. Видеть. Дандас, Пол; Издание Джона Хиннельса. (2002). Джайны . Лондон: Рутледж . ISBN 978-0-415-26606-2.п. 24
- ^ Devendra (. Муни), TG Kalghatgi, TS Devadoss (1983) Источник книги в Джайной философии Удайпур: Шри Тарак Гуру Jain Гран. стр.57. Также см. Таттвартхасутра, стихи 5.29 и 5.37.
- ↑ Фарид Алекбаров (лето 2001 г.). Дарвин 13 века? Взгляды Туси на эволюцию , Azerbaijan International 9 (2).
- ^ Уитакер, Роберт Д. (1975-10-01). «Историческая справка о сохранении массы». Журнал химического образования . 52 (10): 658. Bibcode1975JChEd..52..658W . DOI10.1021 / ed052p658 . ISSN 0021-9584 .
- ↑ Роберт Д. Уитакер, « Историческая записка о сохранении массы », Journal of Chemical Education , 52, 10, 658-659, октябрь 75
- ^ Pismen, Len (2018). Качели науки: от сложности к простоте и обратно . Springer. п. 41. ISBN 978-3-319-99777-3.
- ^ Pomper Филипп (октябрь 1962). «Ломоносов и открытие закона сохранения вещества при химических превращениях». Ambix . 10 (3): 119–127. DOI10,1179 / amb.1962.10.3.119 .
- ↑ Ломоносов, Михаил Васильевич (1970). Михаил Васильевич Ломоносов о корпускулярной теории . Генри М. Лестер (пер.). Кембридж, Массачусетс: Издательство Гарвардского университета . Введение, стр. 25.
- ^ Дорфман, Яков (1961). Закон сохранения при химических реакциях и физические воззрения Ломоносова // Ломоносов М.В. Сборник статей и материалов, Т.5 . http://gidropraktikum.narod.ru/Lomonosov-Dorfman.djvu : М.-Л .: Издательство АН СССР. п. 193.
- ↑ Мэтью Монкриф, Паттисон Мьюир, Элементы химии (1904)
- ^ Nouv. Recherches sur les lois des пропорции химиков (1865) 152, 171, 189
- ^ Журнал «Сохранение массы при химических изменениях» — Химическое общество, Лондон , Том 64 , Часть 2 Химическое общество (Великобритания)
- ^ Уильям Эдвардс Хендерсон, Курс общей химии (1921)
- ^ Ида Фройнд , Исследование химического состава : отчет о его методе и историческом развитии, с иллюстративными цитатами (1904)
- ^ Кеннет Р. Ланг, астрофизическая формулы , Springer (1999), ISBN 3-540-29692-1
Планетарная модель строения атома
(Э.Резерфорд, 1911 г.)
1.Атомы химических элементов
имеют сложное внутреннее строение.
2.В центре атома находится
положительно заряженное ядро, занимающее ничтожную часть пространства внутри
атома.
3.Весь положительный заряд и
почти вся масса атома сосредоточена в ядре атома(масса электрона равна 1/1823
а.е.м.).
4.Вокруг ядра по замкнутым
орбиталям движутся электроны. Их число равно заряду ядра. Поэтому атом в целом
— электронейтрален.
Ядро атома
Ядро атома состоит из протонов и нейтронов (общее название — нуклоны).
Число протонов в ядре атома элемента строго определено — равно порядковому
номеру элемента в периодической системе — Z.
Число нейтронов в ядре атомов одного и того же элемента может быть различным — A — Z (где А — относительная атомная масса элемента; Z — порядковый номер).
Заряд ядраатома определяется числом
протонов. Масса ядраопределяется суммой протонов и нейтронов.
Изотопы
Изотопы —
разновидности атомов определенного химического элемента, имеющие одинаковый
атомный номер, но разные массовые числа. Обладают ядрами с одинаковым числом
протонов и различным числом нейтронов, имеют одинаковое строение электронных
оболочек и занимают одно и то же место в периодической системе химических
элементов.
Относительные атомные массы элементов, приводимые в периодической системе
— есть средние массовые числа природных смесей изотопов. Поэтому они и отличаются
от целочисленных значений.
Пример.
Природный таллий (ат.н.81, ат. масса 204,383) состоит из двух изотопов:
таллий – 203
|
203 |
Tl (81 |
1 |
p; 122 |
1 |
n) — 29,5% |
таллий — 205
|
205 |
Tl (81 |
1 |
p; 122 |
1 |
n) — 70,5% |
Средняя атомная масса таллия равна:
Aср.(Tl) = (0,295 x 203 + 0,705 x 205) / 2 = 204,383
Изотопы водорода имеют специальные символы и названия:
|
1 |
H — протий; |
2 |
D- дейтерий; |
3 |
T- |
Химические свойства изотопов одного элемента одинаковы. Изотопы, имеющие
одинаковые массовые числа, но различные заряды ядер, называются изобарами
|
( |
4018 |
Ar, |
4019 |
K и |
40 |
Ca; |
112 |
Cd и |
112 |
Sn). |
Закон сохранения массы и энергии
Великий русский ученый М.В. Ломоносов в 1748 году стал первым, кто осознал, что масса является фундаментальным свойством, сохраняющимся в процессе химических реакций. Он установил закон который гласит, что суммарная масса всех продуктов химического превращения должна точно совпадать с суммарной массой исходных веществ. Помимо суммарной массы веществ, в химических реакциях сохраняется также число атомов каждого сорта независимо от того, в сколь сложных превращениях они участвуют и как переходят из одних молекул в другие.

В химических реакциях должна сохраняться также и энергия. Химически важный вывод из этого закона заключается в том, что поглощение или выделение тепла (теплота реакции) в конкретной химической реакции не зависит от того, каким путем осуществляется реакция — в одну или несколько стадий. Например, тепло, выделяющееся напрямую при сгорании газообразного водорода и графита (одна из форм углерода), должна совпадать с теплом, выделяющимся, когда водород и углерод используются для получения синтетического бензина, а заем этот бензин используется в качестве топлива. Если бы количество тепла, выделяемого в одной из двух описанных выше вариантов реакции, было неодинаковым, можно было бы воспользоваться этим и проводить более эффективную реакцию в одном направлении, а менее эффективную — в обратном. В результате получился бы циклический бестопливный источник тепла, непрерывно дающий даровую энергию. Но это всего лишь мечты о вечном двигателе, создание которого разрушается об незыблемую стену закона сохранения массы и энергии.

Закон сохранения массы: в процессе химической реакции не происходит образования или разрушения атомов.
Закон сохранения энергии: если сумма двух реакций представляет собой новую, третью реакцию, то теплота третьей реакции равна сумме теплот первых двух реакций. Говорят, что тепловые эффекты реакций аддитивны. Более подробно о законе сохранения тепла вы узнаете в конце данной главы, где все станет просто и ясно.
Кстати, в 1756 году Ломоносов экспериментально подтвердил химический закон сохранения массы, путем обжига металлов в запаянных сосудах. Вместо обжига металлов можно в запаянном сосуде сжечь фтор, закон сохранения массы все равно соблюдается:
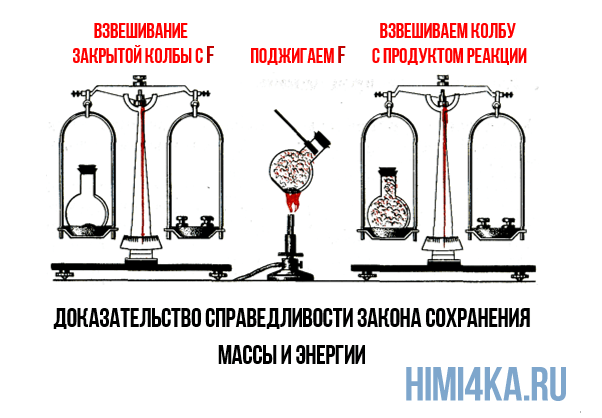
Повторюсь, что не плотность или объем, а именно масса является фундаментальным свойством, сохраняющимся в процессе химических реакций. И как только химики это поняли, они сразу бросились в поиски правильной шкалы атомных масс для каждого элемента. В уроке 3 «Строение молекулы» мы отмечали, что молекулярная масса молекулы вычисляется через сумму всех атомных масс входящих в ее состав атомов. А из урока 5 «Моль и молярная масса» нам известно, что моль любого вещества — это такое его количество, в котором число частиц этого вещества равно 6,022·1023. Масса одного моля вещества в граммах называется молярной массой. Моль и молярная масса являются важнейшими понятиями, без которых невозможно проводить химический расчет.
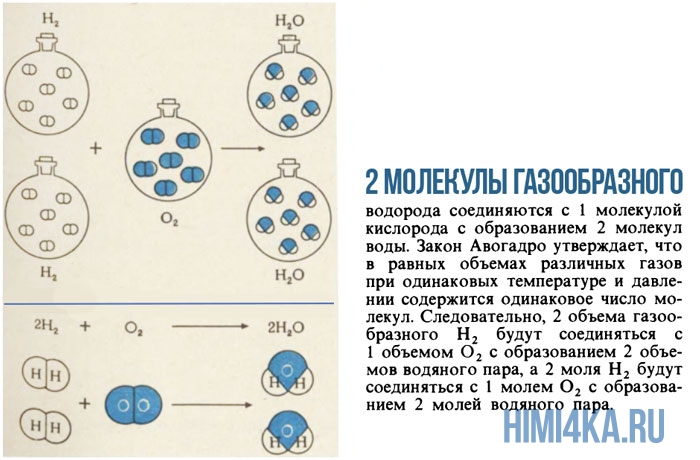
Моль — это просто средство подсчитывать атомы и молекулы порциями по 6,022·1023. Если известно, что две молекулы газообразного водорода H2 реагируют с одной молекулой газообразного кислорода O2, с образованием двух молекул воды H2O, то можно предсказать, что 2 моля H2, т.е. 4,032 г, будут реагировать с 1 молем O2, т.е. с 31,999 г, с образованием 2 молей H2O, т.е.36,031 г). Контрольное суммирование 4,032+31,999=36,031 подтверждают, что в этой реакции выполняется химический закон сохранения массы.
Урок 11 «Формулировка закона сохранения массы и энергии» является повторением уже пройденного материала перед погружением в более серьезный раздел химии. Надеюсь вы открыли в этом уроке для себя что-то новое и интересное. Если у вас возникли вопросы, пишите их в комментарии.
Основные газовые законы
Состояние газа характеризуется его объемом, давлением и температурой. Между этими величинами экспериментально были установлены следующие законы:
- Закон Бойля-Мариотта (изотермический) сокращенно записывается так:
- при Т = const
- Р 1 · V 1 = Р 2 · V 2 , или Р · V = const;
- Закон Гей-Люссака (Изобарный)
- при Р = const
- V 1 / T 1 = V 2 / T 2 , или V / T = const.
- Закон Шарля (Изохорный)
- при V = const
- Р 1 / T 1 = Р 2 / T 2 , или Р / T = const.
Все три закона можно объединить в один универсальный газовый закон , который описывается уравнением Клапейрона:
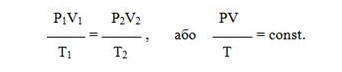
Зависимость для одного моля газа была выведена Менделеевым, поэтому называется уравнением Менделеева-Клапейрона. Оно содержит постоянную величину -универсальную газовую постоянную R.
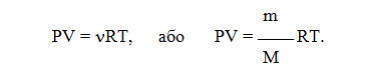

Расчеты значений универсальной газовой постоянной R
Закон постоянства состава
Сущность закона постоянства состава (Пруст, 1801 г.) заключается в том, что каждое химическое соединение независимо от способа и условий ее добычи имеет определенный массовый состав.
Соотношение между массами элементов, входящих в состав определенной соединения, являются постоянными и не зависят от способа получения этого соединения.
Этот закон не имеет абсолютного обобщенного характера, поскольку в природе существует два типа соединений — с постоянным и с переменным составом.
Соединения, которые имеют постоянный состав и целочисленное атомное соотношение компонентов, называются Дальтониды .
К ним относятся вещества, которые в обычных условиях находятся в газообразном (СО2 , NH3 , NO, HCl) или жидком (Н2О, С6Н6) состоянии или могут быть легко переведены в них, а также кристаллические вещества с молекулярной структурой (I2 , лед).
Соединения переменного состава, в которых стехиометрические соотношения компонентов не соответствуют целым числам, называются бертоллидами .
Бертоллиды не имеют молекулярной структуры. К ним относится подавляющее большинство кристаллических соединений переходных d- и f- элементов: оксиды, гидриды, нитриды, сульфиды, карбиды и другие бинарные соединения. Следует заметить, что на постоянство состава влияет и изотопный состав, например, в обычной воде Н2О и в тяжелой воде D2О массовые доли кислорода различаются.
Итак, состав химических соединений зависит от типа химической связи, агрегатного состояния веществ, изотопного состава и условий их добычи и может быть как постоянным, так и переменным. Поэтому в настоящее формулировки закона постоянства состава внесены некоторые уточнения:
Закон объемных соотношений Гей-Люссака
В химических реакциях с участием газов очень часто наблюдается изменение объема реакционной системы. В отличие от постоянства массы веществ, участвующих в реакции и образуются вследствие нее, при взаимодействии газов объем реакционной системы может увеличиваться, уменьшаться или оставаться неизменным. Соотношение между объемами газов устанавливает закон объемных соотношений Гей-Люссака (1808 г.):
Этот закон справедлив только в том случае, когда объемы газов измерены при одинаковых условиях.
Из закона Гей-Люссака следует, что стехиометрические коэффициенты в уравнении реакции являются кратными к объемам газов, которые взаимодействуют и образуются.
С помощью закона объемных соотношений можно рассчитать объемы газов или устанавливать состав исходного газа.
Слайды и текст этой презентации

Закон сохранения массы веществ. Уравнения химических реакций.
Общая средняя школа № 36 имени Казыбек би
Составила : учитель химии, биологии высшей квалификационной категории: Палжанова А.Ш. 2011 год

Единственный путь, ведущий к знанию, — это деятельность.
Цели урока: Обучающие — экспериментально доказать закон сохранения массы веществ. На основе этого закона сформировать понятие о материальном балансе химической реакции. Сформировать понятие об уравнении химической реакции как об условной записи, отображающей превращения веществ
Развивающие — развивать умения ставить несложные проблемы, формулировать гипотезы и проводить их опытную проверку; совершенствовать умения работать с лабораторным оборудованием и реактивами ; развивать способность к логическому мышлению.Воспитательные — продолжить формирование научного мировоззрения учащихся; воспитывать коммуникативную компетентность, а также наблюдательность, внимание, инициативу. На примере жизни и деятельности М
В. Ломоносова воспитывать интерес к изучению химии.

Открытие закона сохранения
массы веществ
1789г.
Роберт Бойль
1673г.
1748г.
М. В. Ломоносов
Антуан Лавуазье

Бойль проделал множество опытов по прокаливанию металлов в запаянных ретортах и всякий раз масса окалины оказывалась больше массы прокаливаемого металла.


Русский учёный М.В. Ломоносов предположил, что чувственный опыт обманывает нас. 5 июля 1748 года он написал в письме Леонарду Эйлеру:

«Все перемены в натуре случающиеся такого суть состояния, что сколько чего у одного тела отнимется, столько же присовокупится к другому. Так, ежели где убудет материи, то умножится в другом месте; сколько часов положит кто на бдение, столько же сну отнимет…»

«Масса веществ, вступивших в реакцию, равна массе образовавшихся веществ в результате реакции» — современная формулировка закона сохранения массы веществ.


Лишь в 1756 году Ломоносову удалось проверить опытным путём теоретически открытый закон сохранения массы веществ. Подобно Бойлю русский учёный делал опыт в запаянных ретортах. Но, в отличие от Бойля, Ломоносов взвешивал сосуды как до, так и после прокаливания не вскрывая.


Значительно позже этот закон,независимо от М.В. Ломоносова,был открыт французским ученым А.Лавуазье.


Химическая формула – условная запись состава вещества с помощью химических знаков и индексов. Индекс показывает число атомов в формульной единице вещества. Коэффициент показывает число несоединенных друг с другом частиц
5Н2О
Коэффициент
Химическая формула
Индекс
На основании данного закона составляютуравнения химических реакций с помощью химических формул, коэффициентов и математических знаков.

Химические уравнения
Химическое уравнение – условная запись химической реакции с помощью химических формул и коэффициентов
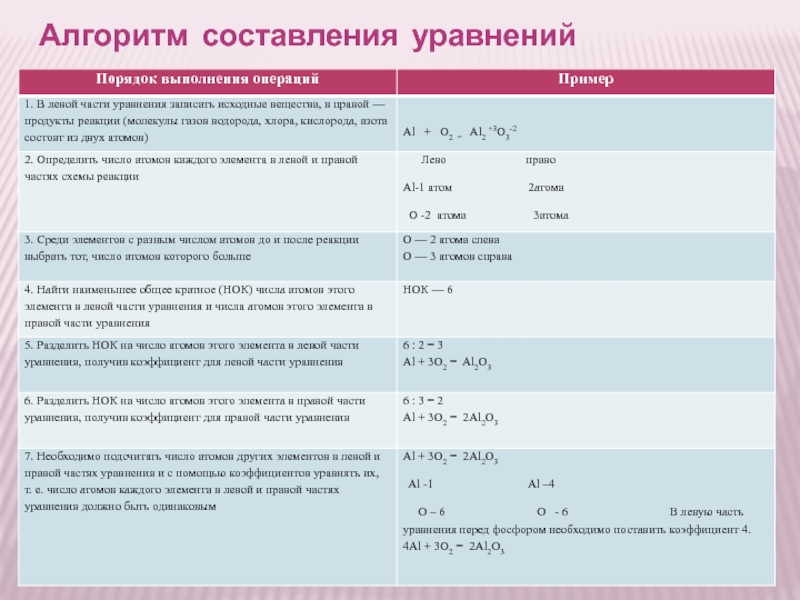
Алгоритм составления уравнений
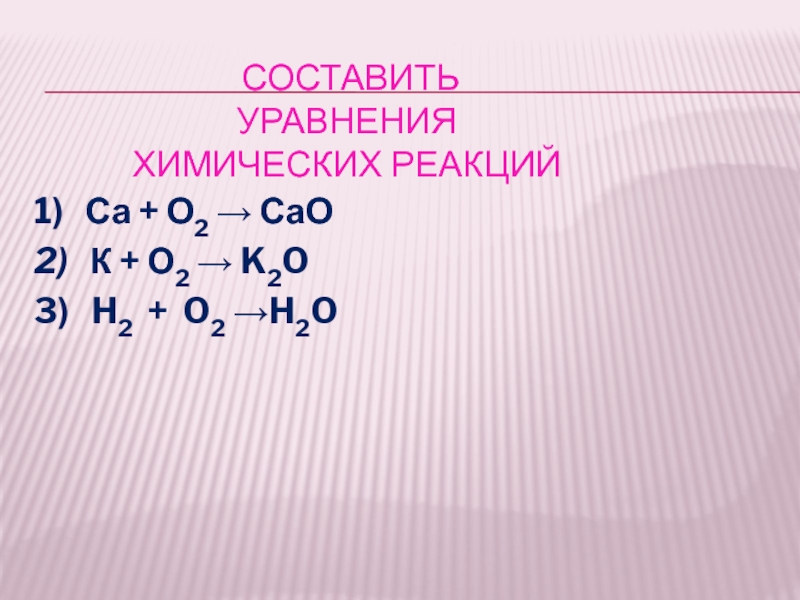
составить уравнения
химических реакций
1) Са + О2 → СаО 2) К + О2 → K2O3) H2 + O2 →H2O

Cu + Cl2 → CuCl2

Запишите уравнение реакции взаимодействия меди с кислородом ( вспомните видеофрагмент)

Домашнее задание:
§ 14,15 стр.40 №6,7.
История
Закон сохранения массы веществ впервые сформулировал М. В. Ломоносов в 1748 году, а экспериментально подтвердил его на примере обжига металлов в запаянных сосудах в 1756 году. Закон сохранения массы веществ Ломоносов связывал с законом сохранения энергии (количества движения). Он рассматривал эти законы в единстве как всеобщий закон природы.
Рис. 1. М. В. Ломоносов.
Но еще до Ломоносова более 20 веков назад древнегреческий ученый Демокрит предполагал, что все живое и неживое состоит из незримых частиц. позже в XVII веке эти догадки подтвердил Р. Бойль. Он проводил эксперименты с металлом и древесиной и выяснил, что вес металла после нагревания увеличился, а вес золы по сравнению с деревом, наоборот, уменьшился.
Независимо от М. В. Ломоносова закон сохранения массы вещества был установлен в 1789 году французским химиком А. Лавуазье, который показал, что при химических реакциях сохраняется не только общая масса веществ, но и масса каждого из элементов, входящих в состав взаимодействующих веществ.
Взгляды Ломоносова и Лавуазье были подтверждены современной наукой. В 1905 году А. Эйнштейн показал, что между массой тела (m) и его энергией (E) существует связь, выражаемая уравнением:
E=mc2,
где c – скорость света в вакууме.
 Рис. 2. Альберт Эйнштейн.
Рис. 2. Альберт Эйнштейн.
Таким образом, закон сохранения массы дает материальную основу для составления уравнений химических реакций.
ОСНОВНЫЕ СТЕХИОМЕТРИЧЕСКИЕ ЗАКОНЫ
1. ОСНОВНЫЕ ЗАКОНЫ ХИМИИ
1.Закон сохранения массы и энергии. Это объединенный закон. В него входят два закона.
Масса веществ, вступивших в реакцию, равна массе продуктов реакции.
Этот закон был открыт М.В. Ломоносовым (1748 г.) и дополнен А.Л.Лавуазье в 1789 г.
В процессе реакции сохраняется масса каждого элемента
Этот закон позволяет составлять уравнения химических реакций и осуществлять расчеты на их основе. Он не является абсолютным. Абсолютным является закон сохранения энергии.
Закон сохранения энергии
Энергия не возникает из ничего и не исчезает, а только переходит из одного вида в другой.
Этот закон – результат работ А. Эйнштейна. Он установил связь между энергией и массой вещества (1905 г.):
Е = mc2,
где с – скорость света в вакууме, равная ~ 300 000 км/с.
Поскольку в результате химической реакции выделяется или поглощается энергия, то, в соответствии с уравнением Эйнштейна, изменяется и масса веществ. Однако это изменение столь мало, что на практике не учитывается (так называемый дефект массы).
Следующие законы справедливы только для соединений с постоянным составом молекул (дальтонидов). Они отличаются от соединений, имеющих переменный состав молекул – бертоллидов.
2. Закон постоянства состава (Ж. Пруст, 1801).
Соотношение между массами химических элементов, входящих в состав данного соединения, есть величина постоянная, не зависящая от способа его получения.
Например, как бы не получали воду – при сгорании водорода (2Н2 + О2 = 2Н2О) или при разложении гидроксида кальция (Са(ОН)2 = СаО + Н2О) – отношение масс атомов водорода и кислорода в реакции равно ~ 1:8.
3. Закон кратных отношений (Дж. Дальтон, 1803).
Если два элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящееся на определенную массу другого, относятся друг к другу как небольшие целые числа.
Этот закон подтвердил атомистическое представление о структуре материи: раз элементы соединяются в кратных отношениях, то химические соединения распадаются на целые атомы. Например, на 1 г азота в его оксидах N2O, NO, N2O3, NO2 и N2O5 приходится 0,57; 1,14; 1,71; 2,28 и 2,85 г кислорода, что соответствует отношению 1:2:3:4:5. Однако в случае соединений переменного состава этот закон неприменим.
4. Закон простых объемных отношений (Ж. Гей-Люссак, 1808).
При равных условиях объем вступающих в реакцию газов относятся друг к другу и к объемам образовавшихся газообразных продуктов как небольшие целые числа.
так, например, в реакции образования аммиака из простых веществ
N2 (г) + 3H2 (г) = 2NH3 (г)
отношение объемов азота (N), водорода (H) и аммиака (NH3) составляет 1:3:2.
5. Закон Авогадро (1811).
В равных объемах различных газов при одинаковых условиях (р и Т) содержится одинаковое число молекул.
Этот закон вытекает из анализа уравнения состояния идеального газа Клапейрона–Менделеева:
рV = nRT.
Это уравнение можно записать для двух газов:
p1V1 = n1RT1;
p2V2 = n2RT2.
При равенстве р1 = р2, Т1 = Т2 и V1 = V2 будут равны и количества вещества газов: n1 = n2 или, с учетом числа Авогадро:
n1· NA = n2· NA,
т.е. будет равно и число молекул газов.
Закон Авогадро имеет следствия:
- Одинаковое число молекул любого газа при одинаковых условиях занимает один и тот же объем.
- Массы газов, взятых в одинаковых объемах при одинаковых условиях (р, Т), относятся друг к другу как их молярные массы:
m1/m2 = M1/M2. (1)
Это следствие вытекает из равенства количеств веществ этих газов n1 = n2.
Подставляя вместо количества вещества отношения его массы к молярной массе n = mMполучим
m1M1= m2M2илиm1m2 = M1M2.
Второе следствие позволяет вывести уравнение для определения молярной массы неизвестного газа по известной величине относительно плотности этого газа по другому известному газу.
После подстановки в числитель и знаменатель левой части уравнения (1) объемов первого и второго газов, которые равны, получаем:
m1 · V2 m2 · V1 = M1M2.
Отношение массы вещества к объему заменяем на плотность (ρ = mV): ρ1/ ρ2 = M1M2
и получим уравнение для расчета молекулярной массы первого газа по второму:
M1 = (ρ1/ρ2) M2 = D1/2M2 (2)
Или в общем виде:
M= DгМг. (3)
где Dг – относительная плотность первого газа по второму.
Если известна плотность данного газа по водороду, то используется уравнение:
М = 2D(Н2). (4)
Если известна плотность газа по воздуху, то используют уравнение:
М = 29 Dвозд. (5)
















![Сохранение массысодержание а также формулировка и примеры [ править ]](http://ieducations.ru/wp-content/uploads/d/5/3/d53d1bc59b8e622c8f07759ee0116393.jpeg)

















