Свойства
Аминокислоты отличаются физическими свойствами от других органических кислот. Все соединения класса – кристаллические вещества, хорошо растворимые в воде, но плохо растворимые в органических растворителях. Они плавятся при высоких температурах, имеют сладковатый вкус и легко образуют соли.
Аминокислоты являются амфотерными соединениями. Благодаря наличию карбоксильной группы -СООН проявляют свойства кислот. Аминогруппа -NH2 обуславливает основные свойства.
Химические свойства соединений:
- горение:
4NH2CH2COOH + 13O2 → 8CO2 + 10H2O + 2N2; - гидролиз:
NH2CH2COOH + H2O NH3CH2COOH + OH; - реакция с раствором щёлочи:
NH2CH2COOH + NaOH → NH2CH2COO-Na + H2O; - реакция с раствором кислоты:
2NH2CH2COOH + H2SO4 → (NH3CH2COOH)2SO4; - этерификация:
NH2CH2COOH + C2H5OH → NH2CH2COOC2H5 + H2O.
Из аминокислотных мономеров образуются длинные полимеры – белки. Один белок может включать несколько разных аминокислот. Например, содержащийся в молоке белок казеин состоит из тирозина, лизина, валина, пролина и ряда других аминокислот. В зависимости от строения белки выполняют различные функции в организме.
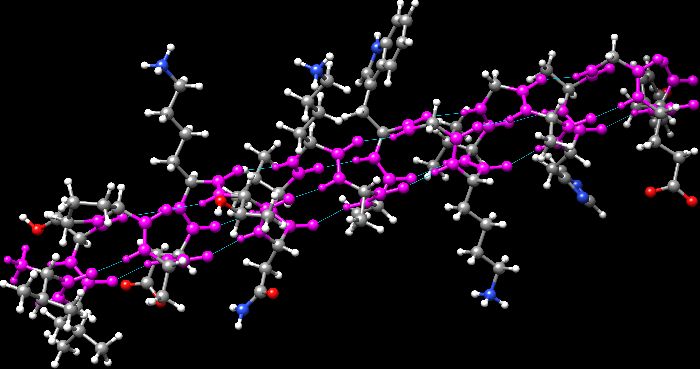 Рис. 3. Белки.
Рис. 3. Белки.
Что мы узнали?
Из урока химии 10 класса узнали, что такое аминокислоты, какие вещества содержат, как классифицируются. Аминокислоты включают две функциональные группы – аминогруппу -NH2 и карбоксильную группу -COOH. Наличие двух групп обуславливает амфотерность аминокислот: соединения обладают свойствами оснований и кислот. Аминокислоты делятся по нескольким признакам и отличаются количеством аминогрупп, наличием или отсутствием бензольного кольца, присутствием гетероатома, взаимодействием с водой.
-
/5
Вопрос 1 из 5
Использование в медицине
Фармакологический препарат аминоуксусной кислоты оказывает успокаивающее (седативное) действие на пациента. Глицин признан мягким транквилизатором, слабым антидепрессантом, позволяющим снижать чувство страха, тревоги, психоэмоционального напряжения.
Глицин включен в перечень веществ, позитивно воздействующих на снижение алкогольного отравления. В качестве вспомогательного препарата данное вещество является ноотропным компонентом, способствует улучшению памяти, ассоциативным процессам.
Глицин стимулирует обменные процессы, активизирует и нормализует процессы защитного торможения, происходящие в центральной нервной системе. При его употреблении повышается умственная работоспособность, снижается психоэмоциональное напряжение.
Благодаря антитоксичному действию, препарат справляется со следующими задачами:
- снижает агрессивность, психоэмоциональное напряжение, конфликтность, повышает социальную адаптацию;
- улучшает настроение;
- облегчает засыпание и нормализует сон;
- повышает умственную работоспособность;
- уменьшает вегетососудистые расстройства;
- понижает токсическое воздействие алкоголя, а также лекарственных препаратов, негативно действующих на центральную нервную систему;
- уменьшает общемозговые расстройства при черепно-мозговой травме, ишемическом инсульте.
Глицин достаточно быстро попадает во многие биологические жидкости и ткани организма, включая и головной мозг. Данная аминокислота метаболизируется до углекислого газа и воды, она не накапливается в тканях.
Анализируемая аминокислота признана регулятором обменных процессов. При систематическом употреблении данного вещества наблюдается адреноблокирующее действие. Часто препарат назначают детям и подросткам с повышенной активностью, выражающейся в отклонениях от нормального поведения.
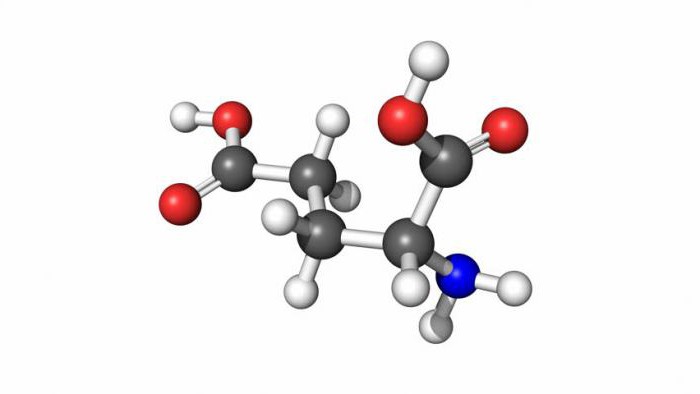
Функции аминокислот в организме
Аминокислоты незаменимые и заменимые необходимы не только для строительства белковых молекул, они выполняют и другие функции:
- Участвуют в формировании других аминокислот.
- Принимают участие в образовании гормонов, медиаторов и нейротрансмиттеров.
- Входят в состав природных соединений: желчных кислот, коферментов, антибиотиков.
- Являются источниками метаболитов, участвующих в обмене веществ.
- Поддерживают умственную активность человека.
- Восстанавливают ткани после повреждений.
- Регулируют работу центральной нервной системы.
- Отвечают за гормональный фон.
Аминокислоты участвуют почти во всех процессах, происходящих в организме.
Что такое аминокислоты?
Аминокислоты – это органические кислоты, содержащие одну или несколько аминогрупп. Эти структурные элементы высвобождаются при гидролизе молекул белков. Они занимают центральное положение в азотистом обмене, так как являются его конечным продуктом.
Они представляют собой структуры кристаллического свойства, имеющие вкусовые качества: сладкие, как глицин, горькие, как лейцин. Под воздействием высоких температур кислоты расплавляются, многие из них водорастворимые. Из кишечника они поступают в кровь, разносятся по тканям, внутренним органам, где синтезируют белки и участвуют в различных химических реакциях.
Определение и наличие аминокислот в составе крови важно для клинической практики, так как по этому признаку можно судить о функционировании почек и печени. При токсикозах в период беременности, нарушенном обмене веществ, деструктивных функциях почек, а также при заболеваниях раком, лихорадочных состояниях количество аминокислот в крови возрастает
Содержание свободных аминокислот в мышечных тканях, мозговых, печени, значительно выше, чем в крови. Связано это с тем, что тканевые клетки активнее концентрируют аминокислоты из среды. Многие аминокислоты применяются в медицине. Это белковые гидролизаты, смеси аминокислот, применяемые в парентеральном питании. Избыток некоторых кислот вызывает токсические явления.
Из чего состоят заменимые и незаменимые аминокислоты
Аминокислоты играют важную роль — принимают участие в биосинтезе белка. Расщепление белка на аминокислоты происходит в желудочно-кишечном тракте человека. Сколько существует аминокислот? Сегодня известно около двухсот пептидов, но всего 20 аминокислот принимают участие в строительстве биологического организма. Поэтому если перед вами стоит вопрос, как запомнить аминокислоты, не стоит паниковать: нужно запомнить всего 20.
Есть заменимые и незаменимые аминокислоты. Также некоторые выделяют условно заменимые аминокислоты.
Заменимые аминокислоты
Определение 2
Заменимые аминокислоты — те аминокислоты, которые попадают в организм человека вместе с продуктами питания.
В самом человеке они тоже могут производиться — из прочих веществ.
Среди таких аминокислот выделяются:
- аланин. Это мономер белков. Он принимает участие в процессе глюкогенеза, становясь глюкозой в человеческой печени. Отвечает за регулирование метаболических процессов;
- аргинин. Синтезируется только в организме взрослых людей — в организме детей образоваться не может. Играет важную роль, к примеру, в системе синтеза гормона роста. Единственная аминокислота, переносящая азот. С ее помощью увеличивается мышечная масса и снижается жировая;
- аспарагин. Является пептидом азотного обмена. Действуя с ферментами, отщепляет аммониак и преобразуется в аспарагиновую кислоту;
- аспарагиновая кислота. Отвечает за образование иммуноглобулинов и деактивацию аммиака. Помогает восстановить баланс в работе сердечного цикла и нервной системы;
- гистидин. Применяют в лечении кишечных заболеваний и в качестве профилактики СПИДа. Уменьшает негативное влияние на человеческий организм стрессовых факторов;
- глицин. Нейромедиатор. Успокаивает;
- глутамин. Составляющая гемоглобина. Отвечает за стимуляцию метаболизма в ЦНС;
- глютаминовая кислота. Отвечает за регуляцию периферической нервной системы;
- пролин. Есть в составе протеинов. Например, в коллагене и эластине;
- серин. Аминокислота, которую можно найти в нейронах головного мозга. Облегчает выработку и высвобождение энергии. Возникает из глицина;
- тирозин. Из этой аминокислоты состоят, в том числе, растительные и животные ткани. В некоторых случаях восстанавливаются из фенилаланина;
- цистеин. Компонент кератина. Принадлежит к антиоксидантам. В отдельных случаях воспроизводится из серина.
Замечание 1
Описанные функции кислот не являются полными и могут быть продолжены.
Незаменимые аминокислоты
Определение 3
Незаменимые аминокислоты — те, синтез которых человеческим организмом не предусмотрен.
Содержатся в отдельных продуктах и поступают в организм с приемом пищи.
В список аминокислот, которые в организме не вырабатываются, входят:
- валин. Повышает координацию функционирования мышц, обеспечивает устойчивость организма к изменениям температуры;
- изолейцин. Его еще называют естественным анаболиком. Отвечает за насыщение мышц необходимой энергией;
- лейцин. Отвечает за регуляцию всех процессов метаболизма. Важный участник процесса построения белковой структуры. Вместе с двумя описанными выше аминокислотами составляет комплекс BCAA (который отвечает за построение мышечной массы). Эта аминокислота, и комплекс в целом, важна для людей, занимающихся спортом. Она помогает увеличить мышечную массу, понизить уровень развития ПЖК (подкожно-жировая клетчатка), поддерживать гомеостаз при больших физнагрузках;
- лизин. Его наличие в организме влияет на улучшение регенерации тканей, выработку гормонов, антител и ферментов. Также немаловажную роль эта аминокислота играет в укреплении сосудов. Находится в составе коллагена;
- метионин. Принимает участи в синтезе холина. Сокращает количество жира в печени;
- треонин. Отвечает за укрепление сухожилий и эмали зубов;
- триптофан. Помогает в регуляции эмоционального состояния, лечении психических расстройств личности;
- фениалалнин. Принимает участие в регуляции деятельности кожных покровов путем снижения их пигментации. Восстанавливает водно-солевой баланс верхних слоев кожи.
Нужна помощь преподавателя?
Опиши задание — и наши эксперты тебе помогут!
Описать задание
Химические свойства предельных аминов
Как уже было сказано, амины обратимо реагируют с водой:
Водные растворы аминов имеют щелочную реакцию среды, вследствие диссоциации образующихся оснований:
Предельные амины реагируют с водой лучше, чем аммиак, ввиду более сильных основных свойств.
Основные свойства предельных аминов увеличиваются в ряду.
Вторичные предельные амины являются более сильными основаниями, чем первичные предельные, которые являются в свою очередь более сильными основаниями, чем аммиак. Что касается основных свойств третичных аминов, то то если речь идет о реакциях в водных растворах, то основные свойства третичных аминов выражены намного хуже, чем у вторичных аминов, и даже чуть хуже чем у первичных. Связано это со стерическими затруднениями, существенно влияющими на скорость протонирования амина. Другими словами три заместителя «загораживают» атом азота и мешают его взаимодействию с катионами H+.
Взаимодействие с кислотами
Как свободные предельные амины, так и их водные растворы вступают во взаимодействие с кислотами. При этом образуются соли:
Так как основные свойства предельных аминов сильнее выражены, чем у аммиака, такие амины реагируют даже со слабыми кислотами, например угольной:
Соли аминов представляют собой твердые вещества, хорошо растворимые в воде и плохо в неполярных органических растворителях. Взаимодействие солей аминов с щелочами приводит к высвобождению свободных аминов, аналогично тому как происходит вытеснение аммиака при действии щелочей на соли аммония:
2. Первичные предельные амины реагируют с азотистой кислотой с образованием соответствующих спиртов, азота N2 и воды. Например:
Характерным признаком данной реакции является образование газообразного азота, в связи с чем она является качественной на первичные амины и используется для их различения от вторичных и третичных. Следует отметить, что чаще всего данную реакцию проводят, смешивая амин не с раствором самой азотистой кислоты, а с раствором соли азотистой кислоты (нитрита) и последующим добавлением к этой смеси сильной минеральной кислоты. При взаимодействии нитритов с сильными минеральными кислотами образуется азотистая кислота, которая уже затем реагирует с амином:
Вторичные амины дают в аналогичных условиях маслянистые жидкости, так называемые N-нитрозаминами, но данная реакция в реальных заданиях ЕГЭ по химии не встречается. Третичные амины с азотистой кислотой взаимодействуют также как и с другими кислотами — с образованием соответствующих солей, в данном случае, нитритов.
Полное сгорание любых аминов приводит к образованию углекислого газа, воды и азота:
Взаимодействие с галогеналканами
Примечательно, что абсолютно такая же соль получается при действии хлороводорода на более замещенный амин. В нашем случае, при взаимодействии хлороводорода с диметиламином:
Получение аминов:
1) Алкилирование аммиака галогеналканами:
В случае недостатка аммиака вместо амина получается его соль:
2) Восстановление металлами (до водорода в ряду активности) в кислой среде:
с последующей обработкой раствора щелочью для высвобождения свободного амина:
3) Реакция аммиака со спиртами при пропускании их смеси через нагретый оксид алюминия. В зависимости от пропорций спирт/амин образуются первичные, вторичные или третичные амины:
Что такое аминокислоты
Разгадка их строения находится в названии. Слово «амино» говорит о наличии аминогруппы – NH2, а «кислоты» — о присутствии в составе кислотной карбоксильной группы – СООН. По-другому, данная группа соединений состоит из карбоновой кислоты, один из атомов водорода которой замещен на аминогруппу.
Формула не так проста: между аминогруппой и карбоксильной группой находится углеродный скелет аминокислоты, который отличается функциональными группами. Поэтому строение аминокислот различно, как и их формулы. Наличие кислотных и основных свойств делает их амфотерными (нейтральными) соединениями. Кислые аминокислоты – не совсем верное выражение, да и вкус у них сладковатый.
Это кристаллические вещества, которые плавятся при высоких температурах (+250°С) и хорошо растворяются в воде, но сохраняют состав в большинстве органических растворителей. Большинство веществ этой группы обладают сладким вкусом.
Они способны образовывать соли, эфиры, но основное химическое свойство аминокислот – это возможность создавать белковые макромолекулы. Соединяясь между собой аминокислоты обрадуют петпиды (кусочки белкового скелета). Две кислоты образуют дипептид:
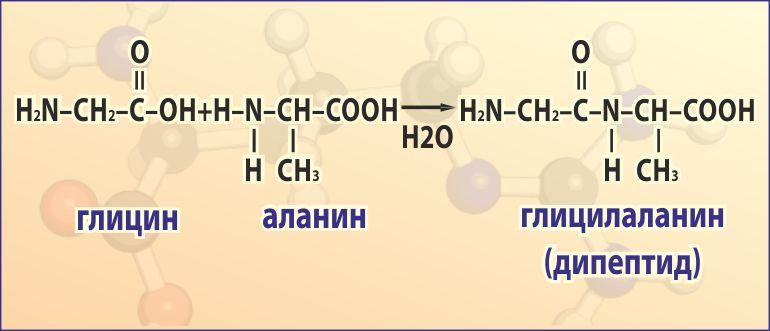
Три собираются в трипептид, четыре формируют тетрапептид и так постепенно идет сборка белковой макромолекулы. Ответ, зачем нужны аминокислоты, кроется в создании огромного разнообразия белков. Они являются мономерами, из которых строится крупная полимерная нить белка со своей формулой и свойствами.
Представим себе аминокислоту (АМК) в виде бусины. Разные бусины нанизываем на длинную нить. Это первичное строение белка. Затем эту нить сворачиваем в виде зигзага, чтобы некоторые бусинки соприкасались между собой. Так получается вторичная структура. Затем эту нить еще несколько раз скручиваем, чтобы образовался клубок, и выходим на третичную структуру. Несколько бусин-клубков, соединенных вместе, образуют четвертичную структуру. Каждый белок устроен непросто, но благодаря строению и свойствам аминокислот создаются особые конфигурации разных белковых макромолекул со своим строением и уникальной формулой.
Химические свойства аминокислот
В зависимости от соединений, аминокислоты могут проявлять различные свойства.
Взаимодействие аминокислот:
Аминокислоты как амфотерные соединения образуют соли и с кислотами, и со щелочами.
Как карбоновые кислоты аминокислоты образуют функциональные производные: соли, сложные эфиры, амиды.
Взаимодействие и свойства аминокислот с основаниями
:
Образуются соли
:
NH 2 -CH 2 -COOH + NaOH NH 2 -CH 2 -COONa + H2O
Натриевая соль + 2-аминоуксусной кислоты Натриевая соль аминоуксусной кислоты (глицина) + вода
Взаимодействие со спиртами
:
Аминокислоты могут реагировать со спиртами при наличии газообразного хлороводорода, превращаясь в сложный эфир
. Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
NH 2 -CH 2 -COOH + CH 3 OH NH 2 -CH 2 -COOCH 3 + H 2 O.
Метиловый эфир / 2-аминоуксусной кислоты /
Взаимодействие с аммиаком
:
Образуются амиды
:
NH 2 -CH(R)-COOH + H-NH 2 = NH 2 -CH(R)-CONH 2 + H 2 O
Взаимодействие аминокислот с сильными кислотами:
Получаем соли:
HOOC-CH 2 -NH 2 + HCl → Cl (или HOOC-CH 2 -NH 2 *HCl)
Таковы основные химические свойства аминокислот.
Моноаминомонокарбоновая кислота
Теория Сено и Ямабе носит более общий характер, поскольку рассматривает не только сорбцию моноаминомонокарбоновых кислот на катионитах, но и сорбцию других групп аминокислот как на катионитах, так и на анионитах.
Химический состав их хотя и различен, но все же в них следует отметить преобладание моноаминомонокарбоновых кислот, и притом в большом количестве. Для кератинов характерно большое содержание цистина, не встречающегося в таком количестве ни в каком-либо другом белке.
Постоянство коэффициентов активности в фазе ионита для резинатов наблюдается на обычных, стандартных синтетических полимерных сульфокатионитах с простейшими моноаминомонокарбоновыми кислотами в качестве противоионов.
Для таких ионитов и противоионов с использованием разбавленных растворов ( ух и у2 постоянны) можно оценить коэффициенты активности fi и у2 также как постоянные.
Ориентировку в хроматограммах, полученных при применении различных двумерных систем растворителей, мы облегчим, если соединим положения алифатических моноаминомонокарбоновых кислот линией.
Добавление кислот или оснований сильно сказывается на величинах RF для дикарбоновых и основных аминокислот и мало сказывается на движении моноаминомонокарбоновых кислот.
Эти изменения связаны с изменением степени диссоциации указанных аминокислот.
В то время как из метилового эфира свободной аминокислоты и из эфиров дипептидов предпочтительно образуются дикетопиперазины, некоторые эфиры трипептидов моноаминомонокарбоновых кислот обнаруживают ярко выраженную склонность к поликонденсации.
Дан обзор теоретических представлений о механизме сорбции аминокислот на ионитах.
Рассмотрена теория сорбции моноаминомонокарбоновых кислот на катионитах в Н — форме, диаминомонокарбоновых кислот на катионитах в Н — форме и анионите в ОН-форме, моноамино-дикарбоновых кислот на катионитах в Н — форме, и анионитах в ОН-форме. Приведены соответствующие уравнения изотерм сорбции.
Таким путем отделяют растворимые в указанных спиртах моноаминомонокарбоновые кислоты и пролин от дикарбоновых кислот и гексоновых оснований.
Химические свойства аминокислот обусловлены количеством и взаиморасположением входящих в их состав функциональных групп. Например, в результате взаимного погашения свойств карбоксильных и аминных групп моноаминомонокарбоновые кислоты — вещества практически нейтральные. Но поскольку в реакциях эти кислоты могут проявлять и кислотные, и основные свойства, они являются амфотерными электролитами.
Экспериментальные исследования изотерм сорбции аминокислот Н — формой сульфокатионитов, выполненные нами, полностью подтвердили справедливость приведенных выше уравнений. В работе были использованы следующие аминокислоты: глицин, 6-аминопенициллановая кислота ( 6 — АПК) и моноамид аспарагиновой кислоты ( аспарагин), который в этих условиях ведет себя как моноаминомонокарбоновая кислота.
Связи между этими параллельными слоями осуществляются через остатки R аминокислот. Между этими остатками могут существовать в принципе силы электростатического притяжения между группами С00 — и NHjJ, водородные связи между спиртовыми и фенолышми НО группами оксиаминокислот и вандерваальсовы связи между неполярными цепями R моноаминомонокарбоновых кислот.
Все эти силы, несомненно, способствуют устойчивости волокна.
В зависимости от наличия циклов в молекулах аминокислот все аминокислоты делят на ациклические, или алифатические, и циклические. В зависимости от числа амин-ных и карбоксильных групп в молекуле ациклические аминокислоты делятся на три группы:
1) моноаминомонокарбо-новые кислоты, 2) моноаминодикарбоновые кислоты и 3) диам и н омонокарбоновые кислоты.
Аминокислоты белков
Аминокислоты, имеющие как амин-, так и карбоксильную группу, прикрепляются к первому (альфа-) атому углерода имеют особое значение в биохимии. Они известны как 2-, альфа или альфа-аминокислоты (общая формула в большинстве случаев H2NCHRCOOH, где R представляет собой органический заместитель, известный как «боковая цепь»); часто термин «аминокислота «относится именно к ним. Это 23 протеиногенных (то есть «служащих для строительства белка») аминокислоты, которые сочетаются в пептидные цепи («полипептиды»), обеспечивая построение широкого спектра белков. Они являются L-стереоизомерами («левыми» изомерами), хотя у некоторых бактерий и в некоторых антибиотиках встречаются некоторые из D-аминокислот («правых» изомеров). 20 из 23 протеиногенных аминокислот кодируются непосредственно триплетными кодонами в генетическом коде и известны как «стандартные» аминокислоты. Остальные три («нестандартные» или «неканонические») – это пирролизин (встречается у метаногенных организмов и других эукариотов), селеноцистеин (присутствует во многих прокариотах и в большинстве эукариотов) и N-формилметионин. Например, 25 человеческих белков включают в свою первичную структуру селеноцистеин, и структурно характеризуются как ферменты (селеноэнзимы), использующие селеноцистеин в качестве каталитического фрагмента на своих активных участках. Пирролизин и селеноцистеин кодируются с помощью вариантных кодонов; например, селеноцистеин кодируется стоп-кодоном и элементом SECIS (инсерционной последовательностью селеноцистеина). Комбинации кодон-тРНК (транспортная рибонуклеиновая кислота), которые не встречаются в природе, также можно использовать для «расширения» генетического кода и создания новых белков, известных как аллопротеины.
Что такое аминокислоты
Где встречаются
Строительные блоки любой макромолекулы сходны по строению, т. е. имеют одинаковые химические группировки, своего рода скелет, характерный для каждого вида.
Он образуется при соединении строительных блоков химической связью и состоит из повторяющихся одинаковых групп. В основе белковой молекулы лежит пептидная связь, возникающая при реакции аминогруппы одной аминокислоты с карбоксильной группой другой аминокислоты. От неизменного пептидного скелета ответвляются боковые группы аминокислот, строение которых зависит от вида аминокислоты. Каждый белок имеет свой неповторимый аминокислотный состав и уникальный порядок соединения аминокислот, называемый первичной структурой белка.
Для удобства двадцать главных аминокислот обозначают символами, используя одну или первые три буквы русского или английского наименования, например, аланин — Ала или А, глицин — Гли или G. Белки разного размера включают в себя от нескольких десятков до нескольких сотен и даже тысяч аминокислот. В среднем длина белка — около 300 аминокислот. Одна часть молекул РНК, информационная, диктует последовательность аминокислот в белке, другая, рибосомная, способствует соединению аминокислот в белковую цепь. Хранится информация о составе белков в более прочных молекулах ДНК.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут
Основное значение
Для нормальной жизнедеятельности организм человека нуждается в полном наборе из двадцати основных аминокислот. Они участвуют в обмене веществ и используются в качестве сырья для получения многих биологически активных молекул: гормонов, алкалоидов, пигментов. В некоторых белках содержатся особые аминокислоты, не входящие в число двадцати стандартных. Они образуются модификацией нормальных аминокислот. Например, в белке соединительной ткани коллагене найдены 4-гидроксипролин и 5-гидроксилизин. От пролина и лизина они отличаются только гидроксильной группой. Эта группа необходима для образования прочных волокон коллагена.

































