Законы диффузии и коэффициенты
Если коэффициенты диффузии характеризуют диффузию вещества, необходимо связать их с законами диффузии, описывающими их динамическое поведение. Например, применимый к текучей среде, закон Фика выражает линейную зависимость между потоком вещества и его градиентом концентрации:
-
- Jjзнак равно-ρDяj∇противj{\ displaystyle \ mathbf {J} _ {j} = — \ rho {\ mathcal {D}} _ {ij} \ nabla c_ {j}}
с участием
-
-
Jj{\ displaystyle \ mathbf {J} _ {j}} массовый расход (в кг м −2 с −1 ), ρ{\ displaystyle \ rho} плотность (в кг м −3 ), Dяj{\ displaystyle {\ mathcal {D}} _ {ij}} коэффициент бинарной диффузии (в м 2 с −1 ), противj{\ displaystyle c_ {j}} массовая доля.
-
Dяj{\ displaystyle {\ mathcal {D}} _ {ij}}(в м 2 с -1 ) — бинарный коэффициент диффузии i в j (или j в i). Этот коэффициент характерен для физики ij-взаимодействия. Следовательно, он различается в зависимости от пары, изучаемой. Обычно она носит скалярный характер, но в некоторых случаях может быть тензором , если диффузия не изотропна, то есть зависит от направления в пространстве.
В многовидовой среде этот закон обобщается уравнениями Стефана-Максвелла .
В текучей среде коэффициент диффузии также выражается безразмерным образом через число Шмидта , которое связывает его с кинематической вязкостью , величиной, представляющей диффузию количества движения.
Sпротивзнак равноνD{\ Displaystyle Sc = {\ гидроразрыва {\ nu} {\ mathcal {D}}}}ν{\ displaystyle \ nu}
Газообразные среды
Коэффициент бинарной диффузии зависит только от взаимодействия между i и j (даже если присутствуют другие частицы). Метод Чепмена-Энскога позволяет выразить это в следующей форме:
-
- Dяjзнак равно38(НЕТ2π(1Mя+1Mj))12(kТ)32пσ2Ωяj*{\ displaystyle {\ mathcal {D}} _ {ij} = {\ frac {3} {8}} \ left ({\ frac {N} {2 \ pi}} \ left ({\ frac {1} { M_ {i}}} + {\ frac {1} {M_ {j}}} \ right) \ right) ^ {\ frac {1} {2}} {\ frac {\ left (kT \ right) ^ { \ frac {3} {2}}} {p \ sigma ^ {2} \ Omega _ {ij} ^ {*}}}}
с участием
-
-
НЕТ{\ displaystyle N} Количество Авогадро , k{\ displaystyle k} Постоянная Больцмана , Т{\ displaystyle T} температура, M{\ displaystyle M} молярная масса , п{\ displaystyle p} давление , σ{\ displaystyle \ sigma} диаметр, соответствующий эффективному сечению , Ωяj*(Т){\ displaystyle \ Omega _ {ij} ^ {*} (T)} Интеграл столкновений уменьшен на его значение для столкновения твердых сфер и близок к 1.
-
Интеграл столкновений можно вычислить с помощью реалистичного межмолекулярного потенциала, такого как потенциал Леннарда-Джонса .
Для этих коэффициентов есть базы данных.
Коэффициент термодиффузии связан с теплопроводностью и зависит, в отличие от коэффициента бинарной диффузии, от всех присутствующих частиц. Нет явного вида для где — объемная доля, а — теплопроводность. Следует отметить , что этот коэффициент выражается в кг м с -1 .
DяТ(п,Т,Икся,Mя,λя,Dяj){\ displaystyle {\ mathcal {D}} _ {i} ^ {T} (p, T, x_ {i}, M_ {i}, \ lambda _ {i}, {\ mathcal {D}} _ {ij })}Икс{\ displaystyle x}λ{\ displaystyle \ lambda}
Жидкие среды
Самый успешный метод для жидкостей использует молекулярную динамику , численный метод, который очень сложно реализовать. В целом нас устраивает закон Стокса-Эйнштейна , основанный на законе Стокса и законах стохастического смещения в броуновском движении . Этот закон в принципе справедлив только тогда, когда молекула i заметно больше, чем молекула, составляющая растворитель j:
-
- Dяjзнак равноkТ6πряμj{\ displaystyle {\ mathcal {D}} _ {ij} = {\ frac {kT} {6 \ pi r_ {i} \ mu _ {j}}}}
где — динамическая вязкость . Радиус шара выбирается таким, чтобы его объем был равен молярному объему :
μ{\ displaystyle \ mu} V{\ displaystyle V}
-
- рзнак равно12(VНЕТ)13{\ displaystyle r = {\ frac {1} {2}} \ left ({\ frac {V} {N}} \ right) ^ {\ frac {1} {3}}}
Этот закон может отклоняться на несколько десятков процентов от измерения из-за предположения о размере частиц. Существуют экспериментальные корреляции, которые можно использовать для любых видов и которые эмпирически корректируют выражение Стокса-Эйнштейна.
Твердый
Механизмы диффузии (проникновения) броуновского типа . Поэтому они описываются законом Фика . Переход от одного узла кристаллической решетки к другому осуществляется путем пересечения потенциального барьера благодаря тепловому перемешиванию. Следовательно, соответствующие коэффициенты диффузии «активируются», то есть описываются законом Аррениуса :
-
- Dзнак равноDе-EkТ{\ displaystyle {\ mathcal {D}} = {\ mathcal {D}} _ {0} \, \ mathrm {e} ^ {- {\ frac {E} {kT}}}}
где — энергетический барьер.
E{\ displaystyle E}
Вариант №2
Возьмем стакан воды и капнем в него каплю окрашенной жидкости, например, йода. Через некоторое время вода станет равномерно слабо окрашенной в цвет йода. Это произошло за счет того, что молекулы йода самопроизвольно (т.е. без постороннего вмешательства) перемешались с молекулами воды.
Такой процесс, когда молекулы одного вещества проникают в промежутки между молекулами другого вещества, называется диффузией. Причина диффузии — тепловое движение частиц. Вследствие диффузии происходит выравнивание концентраций вещества в пределах некоторого пространства (в рассмотренном примере – в стакане воды).
Очень просто продемонстрировать диффузию в газах. Если в одном конце комнаты смочить кусочек ваты одеколоном, через несколько секунд запах одеколона можно почувствовать в другом конце комнаты. Причина запаха – диффузия молекул одеколона в воздухе.
В твердых телах диффузия также возможна, но протекает очень медленно.
Диффундировать могут также частицы самого вещества. Такой процесс называется самодиффузией. Например, в результате самодиффузии происходит выравнивание концентраций в смеси изотопов одного и того же вещества.
Еще одна разновидность диффузии – неупорядоченное движение крупных частиц в газе или жидкости вследствие броуновского движения.
Скорость диффузии в газах наиболее высокая. Наименьшая скорость диффузии наблюдается в твердых телах. Скорость диффузии также зависит от массы диффундирующих молекул (атомов) и температуры. Скорость диффузии увеличивается при уменьшении массы диффундирующих частиц и увеличении температуры среды.
В основе математического описания диффузии лежит закон Фика, который был открыт в 1855 г. немецким физиологом и физиком А. Фиком. Затем на основе закона Фика более полное математическое описание диффузии было позже сделано Альбертом Эйнштейном.
Поскольку за счет диффузии происходит выравнивание концентраций вещества в некоторой среде, это явление имеет большое значение для практики. Например, в живых организмах происходит диффузия кислорода из легких в кровь, а затем из крови – в другие ткани.
В основе многих технологических процессов также лежит диффузия. Например, в порошковой металлургии за счет диффузии происходит спекание порошков. Поэтому знание законов диффузии помогает созданию материалов и разработке новых технологий в авиации, космонавтике и других областях современной техники.
А в ядерной физике известна диффузия нейтронов. При этом нейтроны в веществе многократно изменяют направление своего движения и скорость из-за столкновений с атомными ядрами.
7 класс по физике
Диффузия в твердых телах
Для таких субстанций характерно наличие кристаллической решетки, частицы располагаются упорядоченно. Обменный материал зависит от типа связи. Не слишком активны.

Виды связей рассмотрим отдельно:
-
Ионные (соли активных (щелочных) металлов, гидроксиды). Малолетучи, охотно диффундируют из расплавов, растворов. Яркий представитель – поваренная соль (NaCl). Если разместить в воде, не подогревать, не перемешивать, то однородная масса образуется через пару недель.
-
Металлические. Состоят из ионов, атомов и не связанных электронов. Электропроводны, ковки (это касается не всех сплавов — чугун, например, трескается). Для проникновения позолоты на доли миллиметров в медь понадобятся столетия.
-
Атомные. С сильными ковалентными связями. Высокопрочны, хрупки, химически стойки. В процессах переноса участвуют слабо. Алмаз, кремний и его окислы (песок), хрусталь и подобные.
-
Молекулярные. Механически не прочны. Летучи. Это, например, кристаллы йода, твердый CO2 («сухой лед»).
Требуется энергия на разрыв соединения с соседними частицами. Диффундирующие элементы занимают «вакансии» в решетке.
Примеры диффузии в окружающем мире
Роль диффузии в окружающем нас мире очень велика. Одним из важнейших примеров диффузии является кровообращение в живых организмах. Кислород из воздуха проникает в капилляры крови, расположенные в легких, после этого растворяется в них и разносится по всему организму.
В свою очередь углекислый газ диффундирует из капилляров в альвеолы легких. Питательные вещества, выделяемые из пищи путем диффузии проникают в клетки.
У травянистых видов растений диффузия идет через всю их зеленую поверхность, у более крупных цветущих растений – через листья и стебли, у кустарников и деревьев — через трещины в коре стволов и веток и чечевички. Кроме того, примером диффузии в окружающем мире является всасывание воды и растворенных в ней минералов корневой системой растений из почвы.
Именно диффузия является причиной того, что состав нижнего слоя атмосферы является неоднородным и состоит из нескольких газов. К сожалению, в нашем несовершенном мире найдется совсем немного людей, которые не знают, что такое инъекция, также известная как “укол”. Этот вид болезненного, но эффективного лечения также основан на явлении диффузии.
Загрязнение окружающей среды: почвы, воздуха, водоемов — это тоже примеры диффузии в природе. Тающие в синем небе белые облака, так любимые поэтами всех времен — тоже она— известная каждому ученику средних и старших классов диффузия!

Итак, диффузия — это то, без чего жизнь наша была бы не просто труднее, а практически невозможной.
Приведите примеры диффузии в окружающем мире.
Диффузия в жидкости
Рассматриваемый процесс может происходить с веществами во всех трех агрегатных состояниях: газообразном, жидком и твердом. Чтобы отыскать практические примеры этого, стоит просто заглянуть на кухню.

Варящийся на плите борщ — это один из них. Под действием температуры молекулы глюкозинбетанина (вещества, благодаря которому свекла обладает таким насыщенным алым цветом) равномерно реагируют с молекулами воды, придавая ей неповторимый бордовый оттенок. Данный случай — это в жидкостях.
Помимо борща, данный процесс можно увидеть и в стакане чая или кофе. Оба эти напитка имеют столь равномерный насыщенный оттенок благодаря тому, что заварка или частички кофе, растворяясь в воде, равномерно распространяются между ее молекулами, окрашивая ее. На этом же принципе построено действие всех популярных растворимых напитков девяностых: Yupi, Invite, Zuko.
Ответ
1) Растворение чая в воде. 2) Растворение сахара в чае или воде.
3) Распространение запаха духов или одеколона (смешивание воздуха с духами). 4) Засолка овощей, приготовление варенья.
5) Молоко растворяется в кофе. 6) Растворение стирального порошка, марганцовки, соли.
None 9) Смешивание красок художником.
10) Замешивание теста. 11) Приготовление наваристых бульонов, супов, подлив, сладких компотов и морсов.
Важная роль в окружающем мире.
1) Кровообращение в живых организмах. Кислород из воздуха проникает в капилляры крови, расположенные в легких, после этого растворяется в них и разносится по всему организму. В свою очередь углекислый газ диффундирует из капилляров в альвеолы легких. Питательные вещества, выделяемые из пищи путем диффузии проникают в клетки.

2) Еще одним примером диффузии в окружающем мире является всасывание воды и растворенных в ней минералов корневой системой растений из почвы.
3) Причиной того, что состав нижнего слоя атмосферы является неоднородным и состоит из нескольких газов, тоже является диффузия.
4) Укол. Этот вид болезненного, но эффективного лечения также основан на явлении диффузии.
5) Загрязнение окружающей среды: почвы, воздуха, водоемов — это примеры диффузии в природе.
- spishy-u-antoshki.ru
- fb.ru
- autogear.ru
- schoolotvety.ru
Броуновское движение
В далеком 1827 году известный британский ботаник Роберт Броун при помощи микроскопа изучал поведение микроскопических частиц цветочной пыльцы в воде
Он обратил внимание на то, что частички постоянно двигались в хаотичном, не поддающемся логическому объяснению порядке, и это беспорядочное движение не зависело ни от движения жидкости, в которой они находились, ни от ее испарения. Мельчайшие частички пыльцы описывали сложные, загадочные траектории
Интересно то, что интенсивность такого движения не снижается со временем и не связано с химическими свойствами среды, а только увеличивается, если уменьшается вязкость этой среды или размеры движущихся частиц. Кроме этого, большое влияние на скорость движения молекул оказывает температура: чем она выше, тем частицы движутся быстрее.
Что такое вязкость?
Вязкость — это сила сопротивления, которую испытывает частица против своего движения.
Вязкость ощущается во время относительного движения между двумя слоями жидкости. Это сопротивление трению, когда слои жидкости скользят друг по другу во время их движения.
Диффузия двух жидкостей с разной вязкостью; Кредит изображения: Википедия
Когда жидкость используется в качестве смазки и во время транспортировки по трубопроводам, вязкость играет важную роль в определении сил, которые могут быть преодолены. В некоторых процессах, таких как покрытие поверхности, распыление, литье под давлением и т. д., вязкость определяет поток жидкости.
Диффузия в жидкостях
Как протекает диффузия в жидкости?Рассмотрим опыт, который покажет нам, что молекулы, из которых состоят тела, находятся в беспорядочном движении и в жидких телах (рисунок 1).

Рисунок 1. Иллюстрация опыта с водой и медным купоросом
Для начала нальем в стакан раствор медного купороса темно-голубого цвета (часто используется как бытовой антисептик). Затем аккуратно нальем в этот же стакан воды.
Вначале между жидкостями будет видна резкая граница, но со временем она будет размываться. Через 2-3 недели граница исчезнет совсем: процесс диффузии завершится.
Если рассмотреть данный процесс на молекулярном уровне (рисунок 2), то прекрасно видно, что молекулы воды и медного купороса на границе раздела этих двух жидкостей начинают меняться местами, а со временем жидкость в стакане и вовсе станет однородной.
Рисунок 2. Диффузия в жидкостях (раствор медного купороса и вода)
Типы диффузии
Диффузия может быть простая диффузия и быть облегчен другой молекулой
Простая диффузия
Простая диффузия – это просто движение молекул вдоль градиента их концентрации без непосредственного участия каких-либо других молекул. Это может включать в себя либо распространение материала через среду, либо перенос частицы через мембрану. Все приведенные выше примеры были примерами простой диффузии.
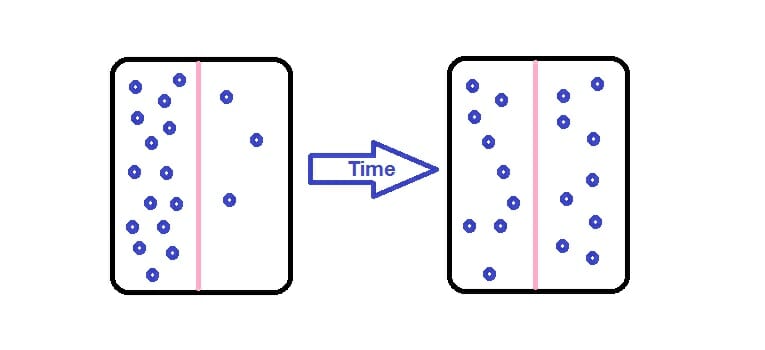
Простая диффузия важна в химических реакциях, во многих физических явлениях и может даже влиять на глобальные погодные условия и геологические события. В большинстве биологических систем диффузия происходит через полупроницаемую мембрану из липидный бислой, Мембрана имеет поры и отверстия для прохождения определенных молекул.
Облегченная диффузия
С другой стороны, облегченная диффузия, как указывает этот термин, требует присутствия другой молекулы (посредника) для того, чтобы произошла диффузия. Облегченная диффузия необходима для движения больших или полярных молекул через гидрофобный липидный бислой. Облегченная диффузия необходима для биохимических процессов в каждой клетке, поскольку существует связь между различными субклеточными органеллами. Например, в то время как газы и небольшие молекулы, такие как метан или вода, могут свободно диффундировать через плазматическая мембрана более крупные заряженные молекулы, такие как углеводы или нуклеиновые кислоты, нуждаются в помощи трансмембранных белков, образующих поры или каналы.
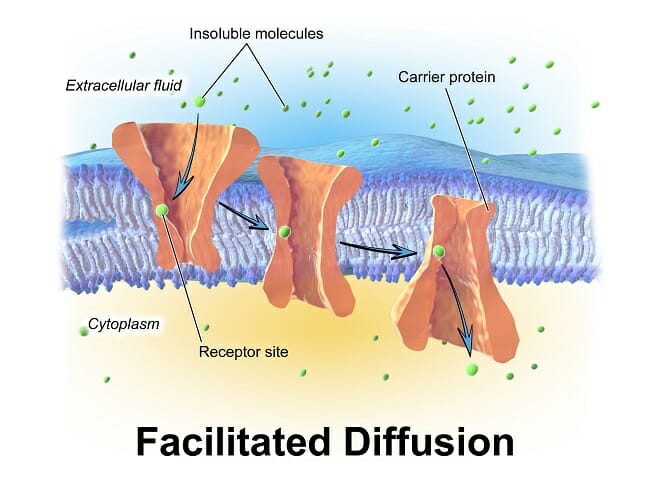
Поскольку они представляют собой относительно большие отверстия в плазматической мембране, эти интегральные мембранные белки также обладают высокой специфичностью. Например, канальный белок который транспортирует ионы калия, имеет гораздо более высокое сродство к этому иону, чем очень похожий ион натрия, с почти таким же размером и зарядом.
- Градиент концентрации – Постепенное снижение концентрации вещества, часто растворенного в растворе. В живых системах этот градиент обычно виден с двух сторон полупроницаемой липидной мембраны.
- гепатоцитов – Клетки во внутренней паренхиматозной области печени, составляющие большую часть массы печени. Участвует в пищеварении и метаболизме белков, липидов и углеводов. Они также играют решающую роль в детоксикации организма.
- Интегральный мембранный белок – Белки, которые охватывают ширину мембраны и являются важными структурными и функциональными частями биологических мембран.
- сублимация – Превращение материала в его твердой фазе непосредственно в газообразное состояние без промежуточного перехода в жидкое состояние.
Диффузия в твердых телах
Кухонный стол, на котором стоят цветы, застелен скатертью яркого желтого цвета. Подобный оттенок она получила благодаря способности диффузии проходить в твердых телах.

Сам процесс придания полотну какого-то равномерного оттенка проходит в несколько этапов следующим образом.
- Частички желтого пигмента диффундировали в красильной емкости по направлению к волокнистому материалу.
- Далее они были впитаны внешней поверхностью окрашиваемой ткани.
- Следующим шагом была снова диффузия красителя, но на этот раз уже внутрь волокон полотна.
- В финале ткань зафиксировала частички пигмента, таким образом окрасившись.
викторина
1. Какое из этих утверждений о диффузии молекул верно?A. Облегченная диффузия полностью обеспечивается гидролизом ГТФB. Никогда не нуждается в присутствии какой-либо другой молекулыC. Диффузия каждой молекулы зависит от градиента ее концентрации и не зависит от концентрации других молекул вид в средеD. Все вышеперечисленное
Ответ на вопрос № 1
С верно. На движение одной молекулы вдоль градиента концентрации не влияют градиенты концентрации любых других веществ в той же среде.
2. Если бы в устье тигля, нагревавшего йод, находилась охлаждающая жидкость, как это повлияло бы на скорость ее диффузии?A. Останется без измененийB. УвеличениеC. УменьшитьD. Это будет зависеть от характера и температуры охлаждающей жидкости
Ответ на вопрос № 2
С верно. Присутствие охлаждающей жидкости в устье тигля понизит температуру газообразного йода. Это уменьшит скорость диффузии.
3. Какое из этих утверждений не соответствует действительности?A. Большие полярные молекулы не могут диффундировать через биологическую мембрануB. Диоксид углерода будет диффундировать быстрее, чем газообразный бромC. Интегральные мембранные белки, которые облегчают диффузию, очень специфичны в отношении своего грузаD. Все вышеперечисленное
Ответ на вопрос № 3
верно. Полярные молекулы могут диффундировать через мембраны, но им необходимо присутствие трансмембранного канала или белка. Углекислый газ легче брома и поэтому быстрее диффундирует.
Как протекает диффузия в жидкостях
Диффузия в жидкостях протекает медленнее. Она может длиться от нескольких минут до нескольких часов.
Самый яркие примеры из жизни:
- Приготовление чая или кофе.
- Смешивание воды и марганцовки.
- Приготовление раствора соли или соды.
 В этих случаях диффузия протекает очень быстро (до 10 минут). Однако если к процессу будет приложено внешнее воздействие, например, размешивание этих растворов ложкой, то процесс пойдёт гораздо быстрее и займёт не более одной минуты.
В этих случаях диффузия протекает очень быстро (до 10 минут). Однако если к процессу будет приложено внешнее воздействие, например, размешивание этих растворов ложкой, то процесс пойдёт гораздо быстрее и займёт не более одной минуты.
Диффузия при смешивании более густых жидкостей будет происходить гораздо дольше. Например, смешивание двух жидких металлов может занимать несколько часов. Конечно, можно сделать это за несколько минут, но в таком случае получится некачественный сплав.
Например, диффузия при смешивании майонеза и сметаны будет протекать очень долго. Однако, если прибегнуть к помощи внешнего воздействия, то этот процесс и минуты не займёт.
3.4. Механизмы диффузии в твердых телах
При
описании некоторых явлений, рассмотренных в предыдущих главах, мы предполагали,
что любой данный атом «привязан» к определенному узлу решетки. В этих случаях
считалось, что атом не совершает никаких перемещений, кроме тепловых колебаний
относительно своего среднего положения. В действительности атомы обладают
большей свободой передвижения и могут переходить из одного узла решетки в
другой. Процесс направленного переноса частиц (атомов, ионов или молекул) в
газах, жидкостях и твердых телах, происходящий за счет случайных смещений и
связанный с тепловым движением этих частиц, называется диффузией. Элементарный акт диффузии состоит в скачке одиночных
частиц или их небольших групп на расстояния порядка межатомного.
Хаотический
обмен местами между атомами, находящимися на поверхности твердого тела и внутри
него, протекает при обычных температурах слишком медленно, чтобы можно было
легко обнаружить последствия этого процесса. Однако при высоких температурах
скорость диффузии такова, что, например, серебряное или хромовое покрытия
«впитываются» в сталь в течение нескольких недель. Другим примером применения
диффузии для получения слоистой структуры может служить кристаллический триод
(транзистор). Требуемые слои примесей можно получить в течение нескольких минут
за счет их диффузии при температуре, близкой к точке плавления германия. Однако
при комнатной температуре строение такого кристаллического триода остается
неизменным практически неограниченно долгое время .
Особое
значение процессы диффузии имеют в тонкопленочных структурах, которые состоят
из нескольких слоев материалов, различных по своей природе. Такие структуры
являются основой практически всех микроэлектронных устройств. Если локальные изменения состава массивных материалов, происходящие
вследствие взаимной диффузии в слоях толщиной несколько микрометров и более,
слабо влияют на свойства этих материалов, то в тонкопленочных композициях такие
процессы диффузии могут привести к коренному изменению состава и структуры
отдельных слоев и, как следствие, к деградации параметров приборов и
интегральных схем и даже выходу их из строя .
Движущей
силой диффузии являются градиенты концентрации dC/dx и температуры dT/dx.
Наиболее распространена свободная
диффузия − диффузия, вызываемая градиентом
концентрации. Она всегда направлена в сторону выравнивания концентрации.
Различают два случая свободной диффузии − гетеродиффузия и самодиффузия. Гетеродиффузия − это диффузия
чужеродных атомов при наличии градиента их концентрации, а самодиффузия −
это случай диффузии в чистом веществе атомов этого же вещества под влиянием
градиента изотопного состава. Искусственным путем такой градиент создают
нанесением на поверхность образца слоя того же вещества, но обогащенного одним
из изотопов. Этот градиент используется для экспериментального определения
коэффициентов самодиффузии.
Кроме свободной, различают еще и вынужденную диффузию. Она возникает под действием направленных
внешних сил. Этот вид диффузии, как правило, приводит не к выравниванию, а к
увеличению градиента концентрации. В зависимости от природы внешних сил,
различают следующие основные виды вынужденной диффузии: термо-,
электро-, баро- и восходящую диффузию.
Термодиффузия происходит под действием
градиента температуры dT/dx. Поток
при этом направлен в сторону более низких температур, например диффузия
носителей заряда от горячего спая к холодному в термоэлектрических
преобразователях энергии.
Электродиффузия протекает под действием
градиента электрического поля dE/dx. В этом
процессе заряженные частицы диффундируют в сторону полюса противоположного
знака, например диффузия в полупроводниках под влиянием внутренних
электрических полей, электролитические процессы.
Бародиффузия идет под действием поля
тяжести или давления dP/dx.
Восходящая диффузия возникает под
действием градиента упругих напряжений ds/dx. Поток
атомов больших размеров при этом направлен в сторону, испытывающую напряжения
растяжения, а поток атомов малых размеров − в сжатую область, например
процесс образования примесных атмосфер вокруг дислокаций.
Механизм
Под диффузией в твердых телах понимают процесс взаимопроникновения молекул и атомов между разными веществами. Несмотря на то, что общее описание сходно с тем, какое дают диффузии в газах, ее механизмы существенно отличаются.
Рис. 1. Кристаллическая решетка.
Причина тому одна: в твердых телах атомы связаны в жесткую структуру, называемую кристаллической решеткой. Поэтому движение атомов носит характер малых колебаний вокруг узлов – точек, где их потенциальная энергия минимальна. При наличии дополнительной энергии они могут покидать узлы. Вероятность этого определяется уравнением Больцмана:
$n = n_0 \cdot e^{- \frac {E}{kT}}$, где n_0 – начальная концентрация атомов, E – энергия скачка, k – постоянная Больцмана, а T – температура.
Энергию атом может получить извне или в результате флуктуаций, так как в твердых телах, равно как и в газах, некоторые атомы могут колебаться быстрее и сильнее, чем остальные. Дальше возможны два механизма:
- Атом занимает свободный узел (вакансию, отсюда и название – вакансионный механизм) в решетке другого тела,
- Атом мигрирует в пространстве между узлами, пока не займет вакансию.
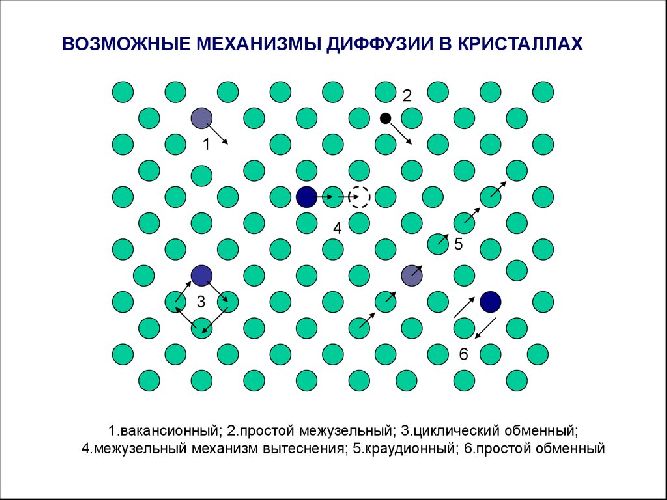 Рис. 2. Механизмы диффузии в твердых телах.
Рис. 2. Механизмы диффузии в твердых телах.
Существует также третья возможность, когда близко расположенные атомы меняются местами, но роль этого механизма незначительна. Из всех трех наибольший интерес представляет вакансионный, хотя на практике в диффузии участвуют все три механизма сразу. Для его описания применяют понятие градиента плотности вакансий аналогично градиенту концентрации газа. Закон Фика для диффузии в твердых телах:
$ \vec j = – D \cdot gradn_0$, где j – поток диффундирующего вещества, D – коэффициент диффузии, а n – начальная плотность вакансий.
В отличие от газов, в твердых телах диффузия маловероятна, а скорость ее низка (в обычных условиях это может длиться годами), поскольку для ее осуществления необходимо, чтобы рядом с атомом, обладающим высокой энергией, оказался свободный узел. Ключ к ее преодолению в уравнении Больцмана. Из него следует, что вероятность диффузии растет по экспоненте при повышении температуры тела.
Другой особенностью твердых тел в сравнении с газами является возможность самодиффузии. Коэффициент ее для вакансионного механизма определяется выражением: $D = \frac {1}{6} \cdot \frac {a^2}{t}$, где a – параметр решетки (размер элементарной ячейки), t – среднее время нахождения атома в узле.
Пример диффузии веществ
С помощью последующей формулы можно рассмотреть пример диффузии вещества из внутреннего объема к поверхностному слою катализатора или реагирующих веществ. Таким образом, превращение вещества будет иметь вид реакции первого порядка, если скорость равняется
Wхим=ksCп, при этом:
Wхим – количество вещества, взятого для реакции у поверхности S в единицу времени;
Сп – показатель концентрации реагента у поверхности.
Вследствие превращения показатель Сп в объеме раствора Соб становится значительно меньше в сравнении с концентрацией вещества.
Всю реагирующую смесь можно разделить на две области:
- с постоянной концентрацией ниже поверхности реакции;
- со скоро меняющейся концентрацией непосредственно вблизи этой поверхности.
С помощью экспериментов было определено нулевое значение скорости, с которой движется жидкость на всех твердых граничащих с ней поверхностях. Вещество перемещается сквозь прилегающий к грани твердого тела недвижный слой жидкости, чему как раз и способствует диффузия реагирующих компонентов.
Замечание
Недвижимый слой имеет специально данное ему название – слой Нернста Его толщина будет зависеть от таких факторов как свойства растворителя и растворенного в нем вещества, а также скорости перемещения и прочих.
Например, для жидкости приемлемая толщина данного слоя δ находится в диапазоне примерно от 0.02 мм до 0.05 мм а то и меньше. Вне этих пределов движение жидкости может спровоцировать выравнивание концентраций в объеме раствора. При помощи уравнения Фика определяется перенос массы вследствие диффузии
dn/dt=−SDdC/dx, при этом:
dn/dt – количество диффундирующего за единицу времени вещества через фиксированную поверхность S в направлении к возрастающим значениям x$, где;
x – направление процесса перемещения;
D – коэффициент диффузии.
Условия ускорения диффузии. Коэффициент диффузии
Разобравшись с тем, в каких веществах может происходить рассматриваемый процесс, стоит узнать об условиях его протекания.
В первую очередь быстрота диффузии зависит от того, в каком агрегатном состоянии пребывают взаимодействующие вещества. Чем больше в котором происходит реакция, тем медленнее ее скорость.
В связи с этим диффузия в жидкостях и газах всегда будет проходить более активно, нежели в твердых телах.
К примеру, если кристаллы перманганата калия KMnO 4 (марганцовка) бросить в воду, они в течение нескольких минут придадут ей красивый малиновый цвет. Однако если посыпать кристаллами KMnO 4 кусочек льда и положить все это в морозилку, по прошествии нескольких часов перманганат калия так и не сможет полноценно окрасить замороженную Н 2 О.
Из предыдущего примера можно сделать еще один вывод об условиях диффузии. Помимо агрегатного состояния, на скорость взаимопроникновения частиц влияет также и температура.
Чтобы рассмотреть зависимость от нее рассматриваемого процесса, стоит узнать о таком понятии, как коэффициент диффузии. Так называется количественная характеристика ее скорости.
В большинстве формул она обозначается при помощи большой латинской литеры D и в системе СИ измеряется в квадратных метрах на секунду (м²/с), иногда — в сантиметрах за секунду (см 2 /м).
Коэффициент диффузии равен количеству вещества, рассеивающегося через единицу поверхности на протяжении единицы времени, при условии, что разность плотностей на обеих поверхностях (расположенных на расстоянии равном единице длины) равна единице. Критерии, определяющие D, — это свойства вещества, в котором происходит сам процесс рассеивания частиц, и их тип.
Зависимость коэффициента от температуры можно описать при помощи уравнения Аррениуса: D = D 0exp (-E/TR).
В рассмотренной формуле Е — минимальная энергия, необходимая для активации процесса; Т — температура (измеряется по Кельвину, а не Цельсию); R — постоянная газовая, характерная для идеального газа.
Помимо всего вышеперечисленного, на скорость диффузии в твердых телах, жидкости в газах влияет давление и излучение (индукционное или высокочастотное). Кроме того, многое зависит от наличия катализирующего вещества, часто именно оно выступает в роли пускового механизма для начала активного рассеивания частиц.
Задания
Задание №1
Налейте в один стакан холодной воды, в другой — теплой. Опустите в каждый из них несколько кристалликов марганцовки. Объясните наблюдаемое явление.
Марганцовка начнет растворяться в обоих стаканах. Вода будет постепенно окрашиваться — будет идти процесс диффузии.
В стакане с теплой водой, кристаллики марганцовки растворятся быстрее, чем в стакане с холодной водой. Это объясняется тем, что скорость протекания диффузии зависит от температуры. Чем выше температура, тем больше скорость молекул — тем быстрее проходит диффузия (рисунок 4).
Рисунок 4. Диффузия в теплой и холодной воде
Задание №2
Пользуясь рисунком 2, объясните процесс диффузии в жидкостях.
Сначала мы видим четкую границу между двумя жидкостями (между их молекулами). Постепенно эта граница начинает размываться. Идет процесс диффузии. Молекулы воды постепенно проникают между молекулами медного купороса, а молекулы медного купороса проникают между молекулами воды. В конце концов, обе жидкости смешаются. Процесс диффузии завершится и мы получим однородную жидкость (раствор медного купороса).
Задание №3
Если у вас дома имеется комнатное растение, проведите его подкормку путем опрыскивания кроны питательным раствором. Пронаблюдайте, как булет развиваться растение. Объясните, на каком явлении основан такой способ подкормки.
Такой тип подкормки (листовая подкормка) способствует более активному росту комнатных растений. Такой способ поддержать рост растения возможен благодаря диффузии. В данном случае диффузия будет происходить между питательными веществами подкормки и поверхностью листьев растения.
Задание №4
Налейте в стакан воды и поставьте его в кастрюлю с теплой водой на плиту, поддерживая температуру $50-60 \degree C$. Насыпьте в стакан соль и размешайте. После того, как соль растворится , досыпьте ее вновь. И так до тех пор, пока не получите насыщенный раствор (то есть соль не будет растворяться). Теперь раствор перелейте в другую емкость, чтобы избавиться от излишков соли на дне. Возьмите самый крупный кристаллик соли, подвесьте его на ниточку и опустите в соляной раствор. Через несколько дней вы увидите, как кристаллик начнет увеличиваться в размере. На каком явлении основан рост кристаллика?
Дело в том, что при понижении температуры растворимость веществ уменьшается. То есть, если бы мы попытались растворить такое же количество соли в холодной воде, то у нас просто бы не получилось это сделать.
Почему же при охлаждении такого раствора соль оседает на подвешенном кристаллике соли, а не выпадает на дно в виде осадка? Причина такого поведения вещества в строении самих молекул соли. Они имеют не шарообразную форму, и они не симметричные. Поэтому они не могут состыковаться друг с другом в любом положении, а только в определенном. Подвешенный кристаллик соли называют центром кристаллизации. Вокруг него и выстраиваются ровными рядами другие молекулы соли из раствора — образуется кристалл.
Так на каком явлении основан рост кристаллика соли? Вышеописанные процессы соответствуют процессу, который противоположен диффузии. Это обратная диффузия.

































