Химические свойства альдегидов и кетонов
Альдегидами называют соединения, молекулы которых содержат карбонильную группу, соединенную с атомом водорода, т.е. общая формула альдегидов может быть записана как
где R – углеводородный радикал, который может быть разной степени насыщенности, например, предельный или ароматический.
Группу –СНО называют альдегидной.
Кетоны – органические соединения, в молекулах которых содержится карбонильная группа, соединенная с двумя углеводородными радикалами. Общую формулу кетонов можно записать как:
где R и R’ – углеводородные радикалы, например, предельные (алкилы) или ароматические.
Гидрирование альдегидов и кетонов
Альдегиды и кетоны могут быть восстановлены водородом в присутствии катализаторов и нагревании до первичных и вторичных спиртов соответственно:
Окисление альдегидов
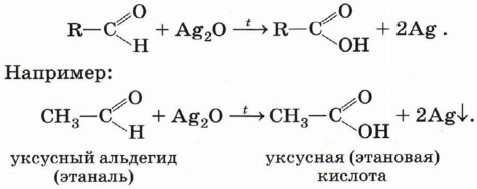
Альдегиды легко могут быть окислены даже такими мягкими окислителями, как гидроксид меди и аммиачный раствор оксида серебра.
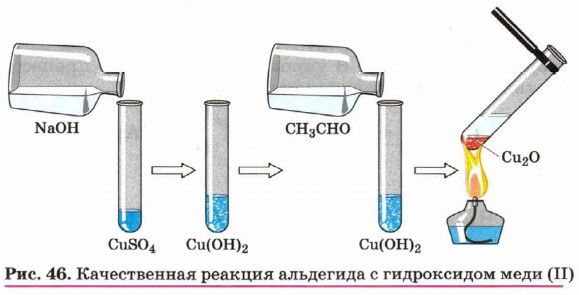
При нагревании гидроксида меди с альдегидом происходит исчезновение изначального голубого окрашивания реакционной смеси, при этом образуется кирпично-красный осадок оксида одновалентной меди:
В реакции с аммиачным раствором оксида серебра вместо самой карбоновой кислоты образуется ее аммонийная соль, поскольку находящийся в растворе аммиак реагирует с кислотами:
Кетоны в реакцию с гидроксидом меди (II) и аммиачным раствором оксида серебра не вступают. По этой причине эти реакции являются качественными на альдегиды. Так реакция с аммиачным раствором оксида серебра при правильной методике ее проведения приводит к образованию на внутренней поверхности реакционного сосуда характерного серебряного зеркала.
Очевидно, что если мягкие окислители могут окислить альдегиды, то само собой это могут сделать и более сильные окислители, например, перманганат калия или дихромат калия. При использовании данных окислителей в присутствии кислот образуются карбоновые кислоты:
История открытия
Углеродистое соединение из группы кетонов получил в конце XVI столетия при нагревании ацетата цинка без доступа кислорода химик из Германии Андреас Либавиль Описали свойства, определили природу вещества, присвоили ацетону систематическое название пропан-2-он в 1832 г. ученые Юстус фон Либих и Дюма Жан-Батист. Официальный термин Aceton ввел немецкий профессор Леопольд Гмелин спустя 16 лет.
Продолжительный период ацетон получали при сухой перегонке древесины, а новые методы производства диметилкетона стали применяться в годы I Мировой войны, когда резко возросла потребность в слезоточивых газах.
Реакции окисления
Альдегиды способны не только восстанавливаться, но и окисляться. При окислении альдегиды образуют карбоновые кислоты. Схематично этот процесс можно представить так:
Из пропионового альдегида (пропаналя), например, образуется пропионовая кислота:
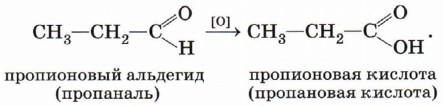
Альдегиды окисляются даже кислородом воздуха и такими слабыми окислителями, как аммиачный раствор оксида серебра. В упрощённом виде этот процесс можно выразить уравнением реакции:
Более точно этот процесс отражает уравнение:
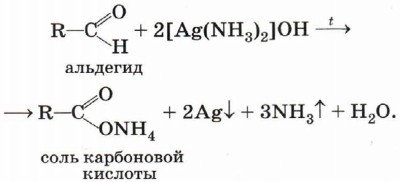
Если поверхность сосуда, в котором проводится реакция, была предварительно обезжирена, то образующееся в ходе реакции серебро покрывает её тонкой ровной плёнкой, образуя зеркальную поверхность. Поэтому эту реакцию называют реакцией «серебряного зеркала». Её широко используют для изготовления зеркал, серебрения украшений и ёлочных игрушек.
Окислителем альдегидов может выступать и свежеосаждённый гидроксид меди (II). Образующийся в ходе реакции гидроксид меди (I) СиОН сразу разлагается на оксид меди (I) красного цвета и воду:
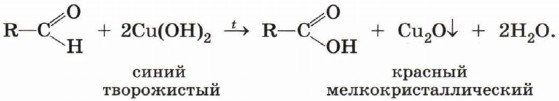
Эта реакция, так же как реакция «серебряного зеркала», используется для обнаружения альдегидов (рис. 46).
Кетоны не окисляются ни кислородом воздуха, ни таким слабым окислителем, как аммиачный раствор оксида серебра.
Альдегиды и кетоны — номенклатура, получение, химические свойства

Альдегиды – органические вещества, молекулы которых содержат карбонильную группу С=O , соединенную с атомом водорода и углеводородным радикалом.Общая формула альдегидов имеет вид:
В простейшем альдегиде – формальдегиде роль углеводородного радикала играет другой атом водорода:
Карбонильную группу, связанную с атомом водорода, часто называют альдегидной:
Кетоны – органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами. Очевидно, общая формула кетонов имеет вид:
Карбонильную группу кетонов называют кетогруппой.В простейшем кетоне – ацетоне – карбонильная группа связана с двумя метильными радикалами:
Номенклатура и изомерия альдегидов и кетонов
В зависимости от строения углеводородного радикала, связного с альдегидной группой, различают предельные, непредельные, ароматические, гетероциклические и другие альдегиды:
В соответствии с номенклатурой ИЮПАК названия предельных альдегидов образуются от названия алкана с тем же числом атомов углерода в молекуле с помощью суффикса -аль.Например:
Нумерацию атомов углерода главной цепи начинают с атома углерода альдегидной группы. Поэтому альдегидная группа всегда располагается при первом атоме углерода, и указывать ее положение нет необходимости.
Наряду с систематической номенклатурой используют и тривиальные названия широко применяемых альдегидов. Эти названия, как правило, образованы от названий карбоновых кислот, соответствующих альдегидам.
Для названия кетонов по систематической номенклатуре кетогруппу обозначают суффиксом -он и цифрой, которая указывает номер атома углерода карбонильной группы (нумерацию следует начинать от ближайшего к кетогруппе конца цепи). Например:
Для альдегидов характерен только один вид структурной изомерии — изомерия углеродного скелета, которая возможна с бутаналя, а для кетонов также и изомерия положения карбонильной группы. Кроме этого, для них характерна и межклассовая изомерия (пропаналь и пропанон).
Химические свойства альдегидов и кетонов
Наличие альдегидной группы в молекуле определяет характерные свойства альдегидов.
1. Реакции восстановления.
Присоединение водорода к молекулам альдегидов происходит по двойной связи в карбонильной группе. Продуктом гидрирования альдегидов являются первичные спирты, кетонов — вторичные спирты. Так, при гидрировании уксусного альдегида на никелевом катализаторе образуется этиловый спирт, при гидрировании ацетона — пропанол-2.
Гидрирование альдегидов — реакция восстановления, при которой понижается степень окисления атома углерода, входящего в карбонильную группу.
2. Реакции окисления. Альдегиды способны не только восстанавливаться, но и окисляться. При окислении альдегиды образуют карбоновые кислоты.
Окисление кислородом воздуха. Например, из пропионового альдегида (пропаналя) образуется пропионовая кислота:
Окисление слабыми окислителями (аммиачный раствор оксида серебра).
Если поверхность сосуда, в котором проводится реакция, была предварительно обезжирена, то образующееся в ходе реакции серебро покрывает ее тонкой ровной пленкой. Получается замечательное серебряное зеркало. Поэтому эту реакцию называют реакцией «серебряного зеркала». Ее широко используют для изготовления зеркал, серебрения украшений и елочных игрушек.
3. Реакция полимеризации:
n СH2=O → (-CH2-O-)n параформ n=8-12
Применение альдегидов и кетонов
Формальдегид (метаналь, муравьиный альдегид) H2C=O:а) для получение фенолформальдегидных смол;б) получение мочевино-формальдегидных (карбамидных) смол;в) полиоксиметиленовые полимеры;г) синтез лекарственных средств (уротропин);д) дезинфицирующее средство;
е) консервант биологических препаратов (благодаря способности свертывать белок).
Уксусный альдегид (этаналь, ацетальдегид) СН3СН=О:а) производство уксусной кислоты;
б) органический синтез.
Ацетон СН3-СО-СН3:а) растворитель лаков, красок, ацетатов целлюлозы;
б) сырье для синтеза различных органических веществ.
Физические свойства и получение оксимов
Физические свойства.
Оксимы, производные альдегидов или кетонов (соответственно альдоксимы RCH=NOH или кетоксимы RR’C=NOH) – жидкости или низкоплавкие твердые вещества (табл. 1), хорошо растворимые во многих органических растворителях, плохо – в холодной воде.
Оксимы альдегидов и несимметричных кетонов существуют в виде двух стереоизомерных форм, например для бензальдоксима: син- (Е, рис. 1,а) и анти- (Z, рис. 1,б), которые могут существенно различаться по своим свойствам. Взаимные превращения стереоизомеров осуществляются при действии кислот или при облучении.
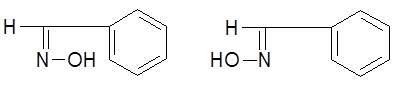
а Рис.1 б
Таблица 1
| Соединение | Мол.м. | Тпл., °С | Ткип., °С |
| Формальдоксим
CH2=NOH |
45.042 | — | 84 |
| Ацетальоксим
CH3CH=NOH |
59.068 | 47 | 115 |
| Бензальдоксим
C6H5CH=NOH |
121.134 | ||
| син- | 36-7 | 200 | |
| анти- | 132 | — | |
| Глиоксим
HON=CHCH=NONH |
88.072 | 178 (c разл.) | возгоняется |
| Ацетоксим
(CH3)2C=NOH |
121.134 | 61 | 134,8 |
| Циклогексаноноксим
C6H10=NOH |
113.158 | 90 | 206-210 |
ИК спектры оксимов имеют 2 слабые полосы поглощения при 3650-3500 и 1690-1650 см -1, отвечающие валентным колебаниям О—Н и C=N связей соотв., и сильную полосу при 960-930 см -1 (валентные колебания N—О-связи).
Методы синтеза
Наиболее распространенным лабораторным методом оксимов является реакции альдегидов и кетонов с гидроксиламином
CH3COCH3 + NH2OH
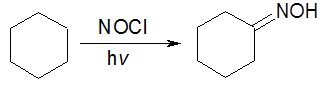
Другим широко используемым методом является изомеризация нитрозосоединений, образующихся in situ при нитрозировании некоторых алканов (например, циклогексана нитрозилхлоридом NOCl) или соединений с активированной метильной либо метиленовой группой:
PhCOCH3 + C5H11ONO
Оксимы также могут быть синтезированы окислением первичных аминов:
RR1CH-NH2 + H2O2
либо восстановлением нитросоединений:
RCH2NO2 +
Применение
Образование оксимов используют для выделения, идентификации и количеств.
определения карбонильных соединений. Некоторые оксимы – аналитические реагенты, например диметилглиоксим применяют для разделения и концентрирования Ni (II), Pd(II) и Re(IV), 1,2-диоксимы – для определения Ni, Co, Сu и платиновых металлов, 2,2′-фурилдиоксим – для определения Pd в рудах, формальдоксим – реагент для фотометрия, определения Mn(III), Ce(IV), V(V) в щелочной среде.
Оксимы применяют для получения пестицидов (например, бутокарбоксим, бутоксикарбоксим), лекарственных препаратов (например, 2-пиридин-альдоксимметиодид), циклогексаноноксим используется в производстве капролактама.
Нахождение альдегидов в природе
В природе, повсеместно встречаются представители различных групп альдегидов. Они присутствуют в зеленых частях растений. Эта одна из простейших групп альдегидов, к которым относится муравьиный альдегид СН2О.
Также встречаются альдегиды с более сложным составом. К таким видам относятся ванилин или виноградный сахар.
Но так как альдегиды обладают способностью легко вступать во всякие взаимодействия, имеют склонность к окислению и восстановлению, то можно с уверенностью сказать, что альдегиды очень способны к различным реакциям и поэтому в чистом виде они встречаются крайне редко. А вот их производные можно встретить повсеместно, как в растительной среде, так и животной.

ОКСОСОЕДИНЕНИЯ: АЛЬДЕГИДЫ И КЕТОНЫ
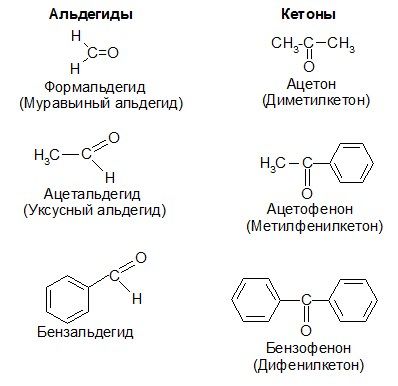
Физические свойства альдегидов и кетонов
Альдегиды и кетоны – жидкости с характерным запахом.
Молекулы альдегидов и кетонов не образуют ассоциатов, поэтому по сравнению со спиртами они имеют более низкие температуры плавления и кипения.
Способы получения альдегидов и кетонов
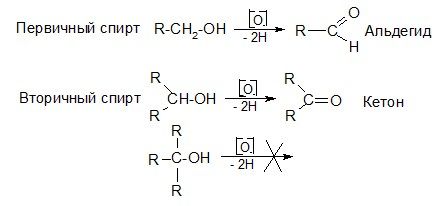
1. Окисление спиртов
При мягком окислении (дегидрировании) первичных и вторичных спиртов образуются соответственно альдегиды и кетоны (см. ” Химические свойства спиртов”).
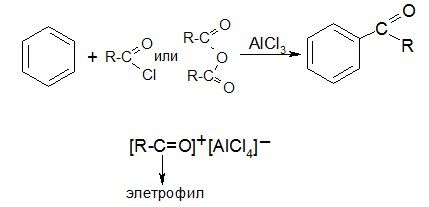
2. Ацилирование ароматических углеводородов
При ацилировании ароматических углеводородов (реакция Фриделя-Крафтса) образуются ароматические кетоны (см. ” Химические свойства аренов”).
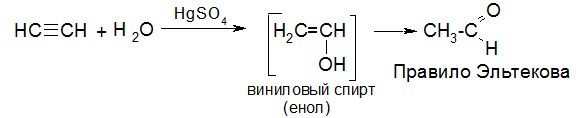
3. Гидратация алкинов
При присоединении воды к тройной связи образуются альдегиды и кетоны (см. ” Химические свойства алкинов”).
4. Оксосинтез – промышленный способ
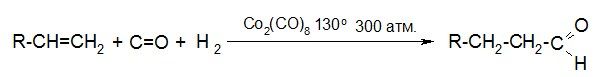
5. Окисление метильных производных бензола
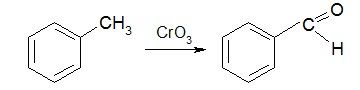
6.Гидролиз геминальных дигалогенопроизводных
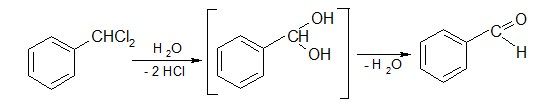
7. Восстановление хлорангидридов кислот
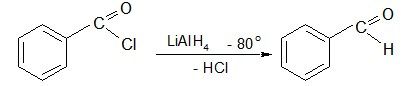
Химические свойства альдегидов и кетонов
Химия альдегидов и кетонов очень разнообразна. Из них можно получить соединения многих других классов.
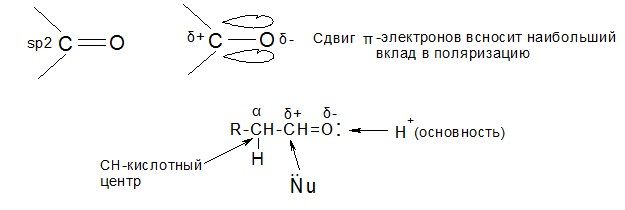
1. Реакции нуклеофильного присоединения к карбонильной группе (AN)
Механизм реакции (Большинство таких реакций обратимы)
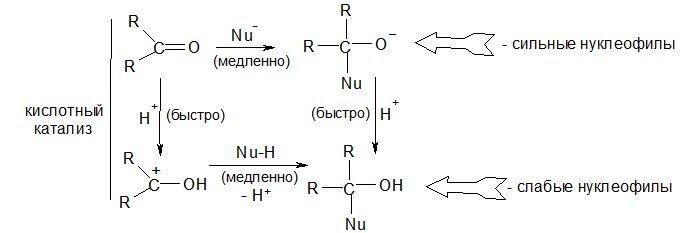
Фактор, определяющий скорость реакции АN – (+)-заряд на карбонильном атоме углерода.
Влияние заместителей на скорость реакци
Электроноакцепторы увеличивают скорость реакции, электронодоноры её уменьшают
Альдегиды более реакционноспособны, чем кетоны: заместитель R – электронодонор).
Ароматические альдегиды менее реакционноспособны, чем алифатические: +М-эффект арильного заместителя больше, чем +I-эффект алкила.
Влияние пространственных факторов на скорость реакции AN:
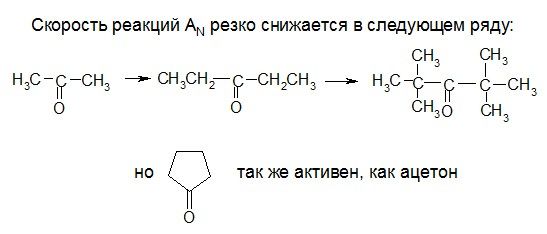
Разновидности реакций AN
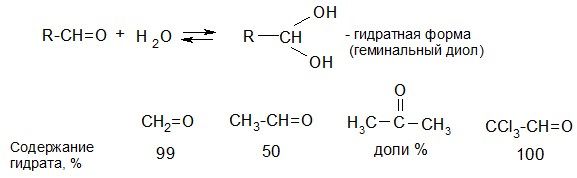
а) гидратация
б) реакция со спиртами (образование полуацеталей и ацеталей)
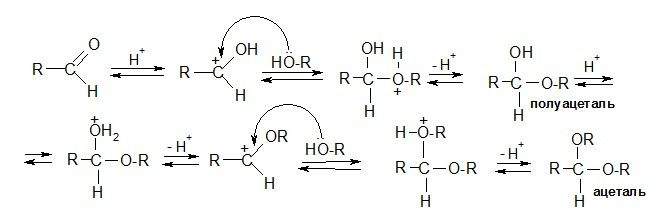
Реакция обратима.
Обратная реакция – это кислотный гидролиз ацеталей.
В щелочной среде ацетали не гидролизуются.
в) реакции с тиолами
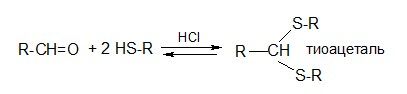
Тиоацетали трудно гидролизуются кислотами, в щелочи они устойчивы.
г) реакции с N-содержащими нуклеофилами
Механизм “присоединение – отщепление”:
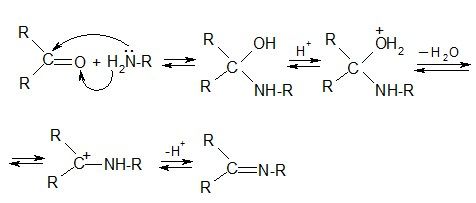
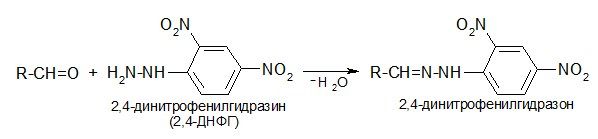
Амины:
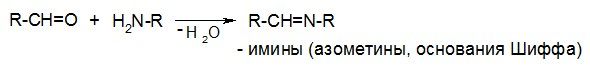
Гидразины:
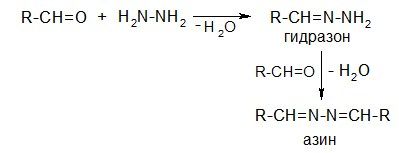
С фенилгидразином и его производными альдегиды и кетоны образуют устойчивые, хорошо кристаллизующиеся вещества, удобные для идентификации исходного соединения. Например:
Гидроксиламин:
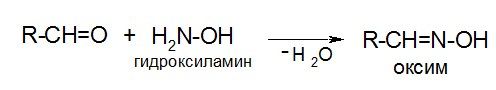
Семикарбазид:
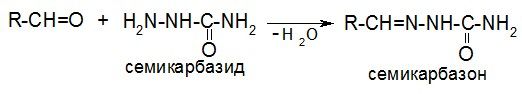
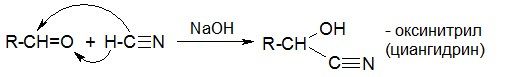
д) реакции с синильной кислотой
е) реакции с магнийорганическими соединениями (реактивами Гриньяра)
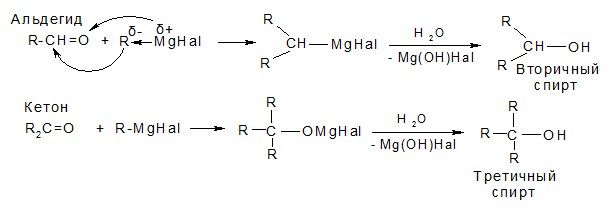
2. Реакции с участием СН-кислотного центра
Галоформные реакции
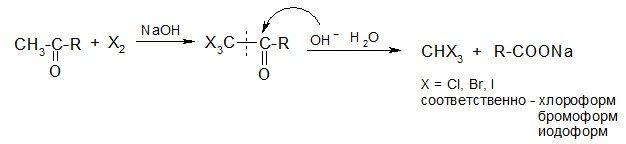
Эти реакции используются для получения галоформов, а также для качественного определения ацетона и других соединений, содержащих в своей структуре фрагменты СН3-С=О или СН3-СНОН.
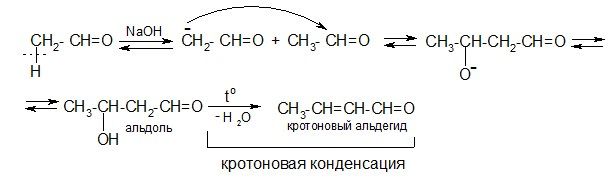
Альдольная конденсация
3. Восстановление (гидрирование)

4. Окисление
Альдегиды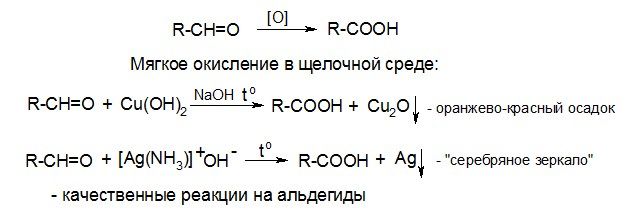
Кетоны
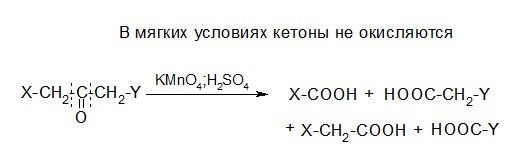
5. Реакции диспропорционирования
Реакция Канницарро – реакция идет с альдегидами, не имеющими Н в α-положении
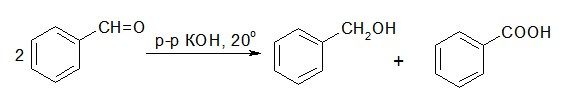
Реакция Тищенко
ХИНОНЫ – ненасыщенные циклические кетоны
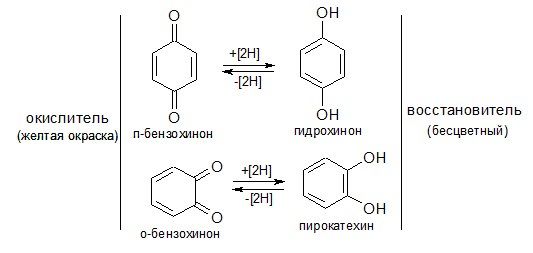
Механизм восстановления – одноэлектронный перенос:
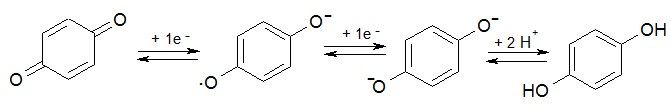
Превращения типа “хинон-гидрохинон” участвуют в процессах биологического окисления:
Примеры решения задач
ПРИМЕР 1
| Задание | Бромированием С n H 2 n +2 получили 9,5 г монобромида, который при обработке разбавленным раствором NaOH превратился в кислородсодержащее соединение. Пары его с воздухом пропущены над раскаленной медной сеткой. При обработке образовавшегося при этом нового газообразного вещества избытком аммиачного раствора Ag 2 O выделилось 43,2 г осадка. Какой углеводород был взят и в каком количестве, если выход на стадии бромирования 50%, остальные реакции протекают количественно. |
| Решение |
Запишем уравнения всех протекающих реакций:
C n H 2n+2 + Br 2 = C n H 2n+1 Br + HBr; C n H 2n+1 Br + NaOH = C n H 2n+1 OH + NaBr; C n H 2n+1 OH → R-CH = O; R-CH = O + Ag 2 O → R-CO-OH + 2Ag↓. Осадок выделившийся в последней реакции – это серебро, следовательно, можно найти количество вещества выделившегося серебра: M(Ag) = 108 г/моль; v(Ag) = m/M = 43,2/108 = 0,4 моль. По условию задачи, после пропускания вещества полученного в реакции 2 над раскаленной металлической сеткой образовался газ, а единственный газ –альдегид – CH 4 + Br 2 = CH 3 Br + HBr. Количество вещества бромметана: v(CH 3 Br) = m/M = 9,5/95 = 0,1 моль. Тогда, количество вещества метана, необходимое для 50% выхода бромметана – 0,2 моль. М(CH 4) = 16 г/моль. Следовательно масса и объем метана: m(CH 4) = 0,2×16 = 3,2 г; V(CH 4) = 0,2×22,4 = 4,48 л. |
| Ответ | Масса метана — масса 3,2 г, объем метана-4,48 л |
ПРИМЕР 2
| Задание | Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: бутен-1 → 1-бромбутан + NaOH → А – Н 2 → В + OH → С + HCl → D. |
| Решение |
Для получения 1-бромбутана из бутена-1 необходимо провести реакцию гидробромирования в присутствии пероксидных соединений R 2 O 2 (реакция протекает против правила Марковникова): CH 3 -CH 2 -CH = CH 2 + HBr → CH 3 -CH 2 -CH 2 -CH 2 Br. При взаимодействии с водным раствором щелочи 1-бромбутан подвергается гидролизу с образованием бутанола-1 (А): CH 3 -CH 2 -CH 2 -CH 2 Br + NaOH → CH 3 -CH 2 -CH 2 -CH 2 OH + NaBr. Бутанол-1 при дегидрировании образует альдегид – бутаналь (В): CH 3 -CH 2 -CH 2 -CH 2 OH → CH 3 -CH 2 -CH 2 -CH = О. Аммиачный раствор оксида серебра окисляет бутаналь до аммонийной соли – бутирата аммония (С): CH 3 -CH 2 -CH 2 -CH = О + OH →CH 3 -CH 2 -CH 2 -COONH 4 + Бутират аммония при взаимодействии с соляной кислотой образует масляную (бутановую) кислоту (D): CH 3 -CH 2 -CH 2 -COONH 4 + HCl → CH 3 -CH 2 -CH 2 -COOH + NH 4 Cl. |
История открытия и изучения
Как и многие органические соединения, выделить и изучить альдегиды и кетоны людям удалось лишь в XIX веке, когда виталистические взгляды полностью рухнули и стало понятно, что эти соединения могут образовываться синтетическим, искусственным путем, без участия живых существ.
Однако еще в 1661 году Р. Бойль сумел получить ацетон (диметилкетон), когда подвергал нагреванию ацетат кальция. Но подробно изучить это вещество и назвать его, определить систематическое положение среди других, он не смог. Лишь в 1852 году Уильямсон сумел довести это дело до конца, тогда и началась история подробного развития и накопления знаний о карбонильных соединениях.

Строение карбоновых кислот
Вещества, содержащие в молекуле одну или несколько карбоксильных групп, называются карбоновыми кислотами.
Группа атомов —
— называется карбоксильной группой, или карбоксилом.
Органические кислоты, содержащие в молекуле одну карбоксильную группу, являются одноосновными.
Общая формула этих кислот RCOOH, например:
Карбоновые кислоты, содержащие две карбоксильные группы, называются двухосновными. К ним относятся, например, щавелевая и янтарная кислоты:
Существуют и многоосновные карбоновые кислоты, содержащие более двух карбоксильных групп. К ним относится, например, трехосновная лимонная кислота:
В зависимости от природы углеводородного радикала карбоновые кислоты делятся на предельные, непредельные, ароматические.
Предельными, или насыщенными, карбоновыми кислотами являются, например, пропановая (пропионовая) кислота:
или уже знакомая нам янтарная кислота.
Очевидно, что предельные карбоновые кислоты не содержат π-связей в углеводородном радикале.
В молекулах непредельных карбоновых кислот карбоксильная группа связана с ненасыщенным, непредельным углеводородным радикалом, например, в молекулах акриловой (пропеновой)
Общие химические свойства альдегидов
- Химические свойства альдегидов определяются прежде всего их функциональной альдегидной группой.
- Для альдегидов характерны окислительно-восстановительные реакции. При реакциях окисления они легко окисляются до карбоновых кислот, при реакциях восстановления образуются спирты.
- Наличие в карбонильной группе двойной связи обусловливает реакции присоединения, реакции полимеризации и поликонденсации, имеющие огромное значение для получения пластмасс.
- Для обнаружения альдегидов служат реакции с фуксинсернистой кислотой, а также с аммиачным раствором оксида серебра (I) и гидроксидом меди (II). Они являются качественными реакциями на альдегиды.
Основные понятия
Основные типы реакций альдегидов: окисления, присоединения, поликонденсации • Фенолоформальдегидная пластмасса • Качественные реакции на альдегиды • Формалин • Окисление спиртов • Способы получения ацетальдегида
Вопросы и задания
1. Почему альдегидная группа определяет основные химические свойства альдегидов? Дайте обоснованный ответ.
2. Какие реакции характерны для альдегидов? Приведите примеры этих реакций, укажите условия их протекания.
3. Какие реактивы используются и какие реакции лежат в основе обнаружения альдегидов? Запишите их уравнения.
4. Какую массу составляет ацетальдегид, полученный из 44,8 м3 ацетилена (н. у.), если практический выход его от теоретически возможного составляет 80 %?
5. Назовите основные области применения формальдегида и ацетальдегида и отразите их схемой.
6. В чём заключается общий способ получения альдегидов? Составьте схему этого процесса и дайте к ней пояснения.
7. Вычислите массу формальдегида (н. у.), который необходимо растворить в воде, чтобы получить 1 л раствора формальдегида с плотностью 1,11 г/мл, или 36%-й раствор формальдегида.
8. Как можно различить растворы глицерина и формальдегида с помощью одного реактива? Представьте проект решения этой экспериментальной задачи.
Выводы
1. Альдегиды и кетоны — кислородсодержащие соединения, имеющие функциональную карбонильную группу
2. Альдегиды — это производные углеводородов, в молекулах которых карбонильная группа связана как с углеводородным радикалом, так и с атомом водорода, их функциональной группой является альдегидная группа Названия альдегидов образуются прибавлением суффикса -аль.
3. Представителями альдегидов являются формальдегид (метаналь) и уксусный альдегид (этаналь), представителем кетонов — ацетон (иропанон).
4. Свойства альдегидов обусловлены их строением. Физические свойства зависят от углеводородного радикала и изомерии. Важнейшие химические свойства альдегидов обусловлены функциональной группой. Для альдегидов характерны реакции: окисления, присоединения, замещения, а также полимеризации и поликонденсации.
5. Качественными реакциями на альдегиды являются: реакция «серебряного зеркала», реакция с Сu(ОН)2 и реакция с фуксинсернистой кислотой.
6. Альдегиды широко применяются как растворители, как сырьё для производства пластмасс, лаков и продукции фармацевтической промышленности. Получают альдегиды окислением спиртов из непредельных углеводородов, а поликонденсацией формальдегида получают фенолоформальдегидные пластмассы.
Химические свойства
Практически все альдегиды способны вступать в разнообразные химические реакции, включая полимеризацию. Сочетание их с другими видами молекул ведет к созданию так званных конденсационных полимеров, которые активно используются, например, при производстве пластмассы, в качестве растворителей и парфюмерных ингредиентов.
А некоторые альдегиды даже принимают активное участие в физиологических процессах, так они являются частью:
витамина А, очень важного для зрения,
пиридоксальфосфата – одной из форм витамина В6,
глюкозы и прочих редуцированных сахаров,
некоторых природных и синтетических гормонов.
Важным отличием альдегидов от тех же углеродов является наличие у них карбонильной группы. Карбонильная группа эта изначально полярна, то есть электроны образующие связь С=О притягиваются больше к кислороду, нежели к углероду. Благодаря этому первый из электронов получает отрицательный заряд, а второй положительный.
Также стоит заметить, что альдегиды имеют более высокий дипольный момент по сравнению с остальными углеводородными соединениями.
Строение молекул
Отличительным признаком альдегидов является наличие в их молекуле альдегидной группы. В её состав входят атомы углерода и кислорода, связанные двойной связью.
Вопрос. Какой тип реакций характерен для соединений с двойной связью?
Поэтому альдегиды легко вступают в реакции присоединения по месту разрыва π-связи карбонильной группы.
Кроме того, в состав альдегидной группы входит атом водорода, соединённый с карбонильной группой.
Вопрос. Является ли эта связь полярной?
За счёт разрыва полярной С–Н связи альдегидной группы альдегиды очень легко окисляются. Атом кислорода альдегидной группы делает эту группу в целом сильно полярной. Поэтому альдегидная группа влияет на углеводородный радикал, и в радикале возможны реакции замещения.

Альдегиды

Органические ЛС
Мы изучаем ЛС,поделенные на группы в соответствии схимической классификацией.
Достоинствомэтой классификации является возможностьвыявления и исследования общихзакономерностей при разработке методовполучения препаратов, составляющихгруппу, методов фармацевтическогоанализа, основанных на физических ихимических свойствах веществ, установлениясвязи между химической структурой ифармакологическим действием.
Все ЛВ делятся нанеорганические и органические.Неорганические, в свою очередь,классифицируются в соответствии сположением элементов в ПС.
А органические– делятся на производные алифатического,алициклического, ароматического игетероциклического ряда, каждый изкоторых подразделяется по классам:углеводороды, галогенпроизводныеуглеводородов, спирты, альдегиды, кетоны,кислоты, эфиры простые и сложные и т.д.
АЛИФАТИЧЕСКИЕСОЕДИНЕНИЯ, КАК ЛС.
Препараты альдегидови их производных. Углеводы
К этой группесоединений относятся органическиелекарственные вещества, содержащиеальдегидную группу, или их функциональныепроизводные.
Общая формула:
Фармакологические свойства
Введение альдегиднойгруппы в структуру органическогосоединения сообщает ему наркотическоеи антисептическое действие. В этомдействие альдегидов сходно с действиемспиртов. Но в отличие от спиртовой,альдегидная группа усиливает токсичностьсоединения.
Факторы влияниястроения на фармакологическое действие
-
удлинение алкильного радикала повышает активность, но одновременно растет токсичность;
-
такой же эффект имеет введение непредельной связи и галогенов;
-
к снижению токсичности приводит образование гидратной формы альдегида. Но способность к образованию устойчивой гидратной формы проявляется только у хлорпроизводных альдегидов.
Так, формальдегид является протоплазматическим ядом, используется для дезинфекции, уксусный альдегид и хлораль не применяются в медицине из-за высокой токсичности, а хлоралгидрат – ЛС, применяется как снотворное, успокоительное.
Сила наркотического(фармакологического) действия итоксичность росли от формальдегида кацетальдегиду и хлоралю. Образованиегидратной формы (хлоралгидрат) позволяетрезко снизить токсичность, сохранивфармакологический эффект.
По физическомусостояниюальдегиды могут быть газообразными(низкомолекулярные), жидкостями итвердыми веществами.Низкомолекулярныеимеют резкий неприятный запах,высокомолекулярные – приятный цветочный.
I. Реакции окисления
Альдегиды легкоокисляются.Окислениеальдегидов до кислотпроисходит под влиянием каксильных, таки слабых окислителей.
Многие металлы – серебро, ртуть, висмут,медь, восстанавливаются из растворових солей, особенно в присутствии щелочи.
Это отличает альдегиды от другихорганических соединений, способных кокислению – спиртов, непредельныхсоединений, для окисления которыхнеобходимы более сильные окислители.
Следовательно, реакции окисленияальдегидов комплексно связаннымикатионами ртути, меди, серебра в щелочнойсреде можно применять для доказательстваподлинности альдегидов.
I. 1.Реакцияс аммиачным раствором нитрата серебра(реакция серебряного зеркала) рекомендуетсяФС для подтверждения подлинности веществс альдегидной группой.В основеокисление альдегида до кислоты ивосстановление Ag+до Ag↓.
AgNO3+ 2NH4OH→ NO3+2H2O
Формальдегид,окисляясь до аммонийной соли муравьинойкислоты, восстанавливает до металлическогосеребро, которое осаждается настенках пробирки в виде блестящегоналета«зеркала» или серого осадка.
I. 2.Реакцияс реактивом Фелинга(комплексное соединение меди (II)с калий-натриевой солью винной кислоты).Альдегиды восстанавливают соединениемеди (II)до оксида меди (I),образуетсякирпично-красный осадок. Готовятперед употреблением).
реактив Феллинга1 — раствор CuSO4
реактив Феллинга2 – щелочной раствор калий-натриевойсоли винной кислоты
При смешавании1:1 реактивов Феллинга 1 и 2 образуетсясинее комплексное соединение меди (II)с калий-натриевой солью винной кислоты:
синееокрашивание
При добавленииальдегида и нагревании синее окрашиваниереактива исчезает, образуется промежуточныйпродукт — желтый осадок гидроксида меди(I),сразу разлагающийся на красный осадококсида меди (I)и воду.
2KNa+R—COH+2NaOH+ 2KOH→R—COONa+4KNaC4H4O6+2CuOH↓+H2O
желтый
2CuOH↓ →Cu2O↓+ H2O
Желтый осадок кирпично-красный осадок
В учебниках инаяобщая схема реакции
R-COH+ K2+3KOH→ R-COOK+ 4KI+ Hg↓+ 2H2O
черный
Приручение похмелья
Не меньше, чем нарушений обмена веществ, вызванных похмельем, пожалуй, только список народных средств для его лечения. Чего только не пробовали для облегчения состояния? Компрессы для ног, все сорта черного, зеленого и цветочного чая (в особенности ромашкового), рассол, соленые и маринованные продукты (вот чего на самом деле следует избегать человеку, чья потревоженная этиловым спиртом и его метаболитами слизистая желудка будет крайне отрицательно относиться к острой и кислой пище), теплое молоко с медом, порция спиртного с небольшим градусом, витамины, занятия спортом, куриный бульон и т. д. Практически все эти средства испытывались клинически, и оказалось, что все они бесполезны. Почему же мы считаем, что они помогают? Да потому что любое, даже самое суровое похмелье рано или поздно проходит и без лечения.
































