Химические свойства алканов
При изучении любых органических веществ следует обратить особое внимание на их химические свойства. Они являются показателем химической активности и реакционной способности соединения.Алканы не реагируют с концентрированными серной и азотной кислотами
Они не обесцвечивают окраску растворов окислителей, таких как перманганата калия или бромной воды.
Реакции замещения
Для алканов свойственны реакции такого типа. Разберем подробнее подвиды реакций замещения.
Галогенирование
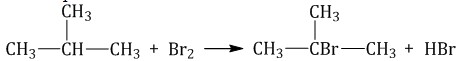
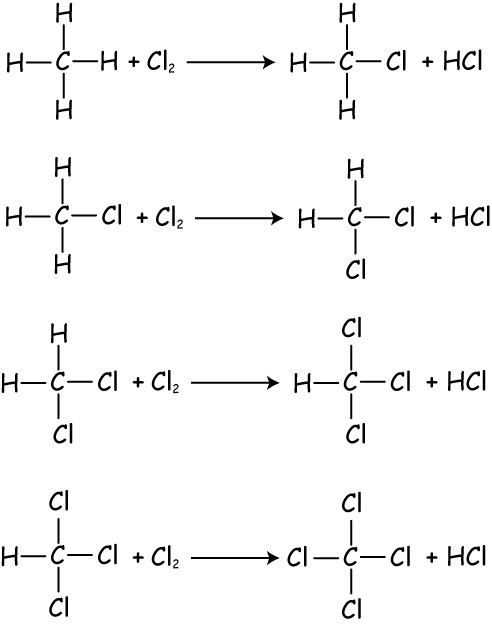
Алканы взаимодействуют главным образом с бромом и хлором. При взаимодействии метана и хлора на свету получим хлорметан (CH3Cl) и хлороводород. Галогенирование проходит в четыре стадии с поочередным замещением атомов водорода в молекуле метана. На второй, третьей и четвертой стадиях свет уже не является обязательным условием реакции.На второй стадии галогенирования выделяется дихлорметан (CH2Cl2), на третьей — хлороформ (CHCl3), на четвертой — четыреххлористый углерод (CCl4).
Рис. 3. Физические свойства алкановОтметим, что данные реакции идут по цепному свободнорадикальному механизму, который состоит из следующих этапов: инициирование цепи, развитие цепи, обрыв цепи или рекомбинация.Возьмем другой случай: пропан взаимодействует с бромом на свету. В данной ситуации один атом брома будет присоединяться к вторичному атому углерода. В результате получим 2-бромпропан и бромоводород. После того, как все атомы водорода вторичного углерода будут замещены на атомы брома, весь последующий бром может присоединяться к первичным углеродам.
Нитрование (реакция Коновалова)
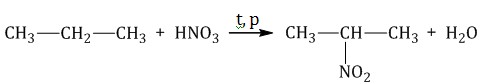
В данном типе реакций возьмем пропан, который взаимодействует с разбавленной азотной кислотой, находящейся в парах. При температуре в 140 градусов образуется соединение под названием 2-нитропропан и вода соответственно.
Сульфирование
Пропан реагирует с концентрированной, дымящейся серной кислотой при термовоздействии. Принцип действия аналогичен реакции нитрования. В данном случае один атом водорода при вторичном углероде замещается на сульфо-группу.Выделится вода и пропан-2-сульфокислота.
Дегидрирование
От алканов отщепляется два атома водорода. Процесс идет при катализаторе или платины при температуре. На выходе получаем алкен и водород.
Реакции окисления
- Полное сгорание — алканы горят с образованием CO2 и H2O. При этом идет выделение энергии до 900 кДж.
- Неполное сгорание — так сгорает, например, гексан. Он взаимодействует с кислородом и образует CO2, H2O и чистый углерод.
- Окисление в мягких условиях — метан взаимодействует с кислородом в присутствии катализатора и при температуре 200 градусов. В ходе данного взаимодействия могут получиться следующие вещества: метанол (CHOH), метаналь (CH2O), муравьиная кислота (CHO).
Реакции изомеризации
Довольно простой тип реакций алканов. В ходе изомеризации из алканов можно получать их изомеры в присутствии катализатора хлорида алюминия и температуры.Например, из нормального бутана с легкостью получаем метилпропан.
Реакции пиролиза
Разложение алканов при термическом воздействии (более 1000 градусов):
- Этан распадается на углерод и водород;
- Метан разлагается на водород и ацетилен, который впоследствии образует углерод и водород.
Крекинг
Данные реакции идут при термическом воздействии и без доступа воздуха. Алкан буквально делится на две части. Из одной в другую переходит один водород. В итоге мы получаем нормальный алкен и нормальный алкан.
Реакции, в которых от алканов отщепляется водород, и появляется ароматическая связь. Взаимодействие идет при действии катализаторов платиновой группы и температуры.Из гексана мы получаем данным способом бензол, а из гептана — толуол. Данное взаимодействие, кстати, является промышленным способом получения бензола.Теперь вы знаете обо всех химических способностях алканов. Осталось их тщательно проработать и выучить.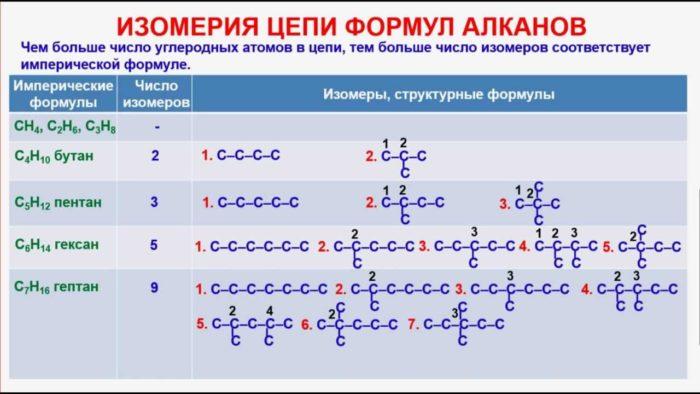
Рис. 4. Изомерия цепи формул алканов
Химические свойства алканов
Реакции замещения.
Наиболее характерными для алканов являются реакции свободнорадикального замещения, в ходе которого атом водорода замещается на атом галогена или какую-либо группу. Приведем уравнения характерных реакций галогенирования (которые протекают при освещении или нагревании):
В случае избытка галогена хлорирование может пойти дальше, вплоть до полного замещения всех атомов водорода на хлор:
Полученные вещества широко используются как растворители и исходные вещества в органических синтезах.
Реакция дегидрирования (отщепления водорода).
В ходе пропускания алканов над катализатором (Pt, Ni, А1203, Сг203) при высокой температуре (400-600 °С) происходит отщепление молекулы водорода и образование алкена:Реакции, сопровождающиеся разрушением углеродной цепи.
Все предельные углеводороды горят с образованием углекислого газа и воды. Газообразные углеводороды, смешанные с воздухом в определенных соотношениях, могут взрываться.
1. Горение предельных углеводородов — это свободнорадикальная экзотермическая реакция, которая имеет очень большое значение при использовании алканов в качестве топлива:В общем виде реакцию горения алканов можно записать следующим образом:2. Термическое расщепление углеводородов.Процесс протекает по свободнорадикальному механизму. Повышение температуры приводит к гомолитическому разрыву углерод-углеродной связи и образованию свободных радикалов.
Эти радикалы взаимодействуют между собой, обмениваясь атомом водорода, с образованием молекулы алкана и молекулы алкена:
Реакции термического расщепления лежат в основе промышленного процесса — крекинга углеводородов. Этот процесс является важнейшей стадией переработки нефти.
3. Пиролиз. При нагревании метана до температуры 1000 °С начинается пиролиз метана — разложение на простые вещества:При нагревании до температуры 1500 °С возможно образование ацетилена:4. Изомеризация. При нагревании линейных углеводородов с катализатором изомеризации (хлоридом алюминия) происходит образование веществ с разветвленным углеродным скелетом:5. Ароматизация. Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола и его производных:Алканы вступают в реакции, протекающие по свободнорадикальному механизму, т. к. все атомы углерода в молекулах алканов находятся в состоянии sp3-гибридизации. Молекулы этих веществ построены при помощи ковалентных неполярных С—С (углерод — углерод) связей и слабополярных С—Н (углерод — водород) связей. В них нет участков с повышенной и с пониженной электронной плотностью, легко поляризуемых связей, т. е. таких связей, электронная плотность в которых может смещаться под действием внешних факторов (электростатических полей ионов). Следовательно, алканы не будут реагировать с заряженными частицами, т. к. связи в молекулах алканов не разрываются по гетеролитическому механизму.
Х и м и я
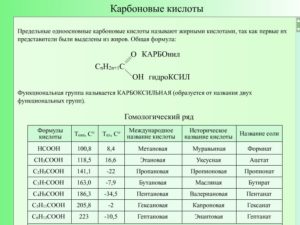
Карбоновые кислоты — это органические соединения, которые характеризуются присутствием в их молекулах карбоксильной группы -СООН.
Карбоксильная группа является функциональной (характеристической) группой этого класса соединений. Примерами карбоновых кислот могут служить:
Кислотный характер этих соединений является результатом того, что атом водорода гидроксильной группы способен диссоциировать с образованием иона водорода, например:
Взаимодействуя с основаниями карбоновые кислоты образуют соли:
Карбоновые кислоты являются слабыми кислотами, поэтому их соли подвергаются обратимоми гидролизу. Наиболее сильные из карбоновых кислот – муравьиная и уксусная.
Карбоновые кислоты со спиртами образуют сложные эфиры
Сложные эфиры – чрезвычайно важное соединение, очень часто встречающееся в продуктах животного и растительного мира
Одноосновные и двухосновные карбоновые кислоты
Карбоновые кислоты делятся одноосновные и двухосновные в зависимости от кличества в их составе гидроксильных групп ОН.
Все карбоновые кислоты, рассмотренные выше – это примеры одноосновных кислот. В их сотавах содержится по одной гидроксильной группе.
Соответственно, в молекулах двухосновных кислот содержится по две гидроксильных группы. К двухосновным карбоновым кислотам относятся, например, щавелевая или терефталиевая кислоты.
Низшие, средние и высшие карбоновые кислоты
По числу атомов углерода в молекуле карбоновые кислоты делят на:
Низшие (С1-С3),
Средние (С4-С8) и
Высшие (С9-С26).
Высшие карбоновые кислоты называют высшими жирными кислотами, по причине того, что они входят в состав природных жиров.
Но иногда жирными называют все ациклические карбоновые кислоты. Таким образом, термины «жирные кислоты» и «карбоновые кислоты» часто используются как синонимы.
Предельные и непредельные карбоновые кислоты
Предельные карбоновые кислоты в своём составе, содержат радикал предельных углеводородов, т.е. радикал только с простыми, одинарными связями.
И наоборот, непредельные карбоновые кислоты в своём составе содержат радикал непредельных углеводородов, т.е. радикал, в котором присутствуют кратные (двойные и тройные) связи.
Высшие карбоновые (жирные) кислоты
Напомним, что высшим карбоновым кислотам относят такие карбоновые кислоты, молекулы которых содержат сравнительно большое число атомов углерода (С9-С26).
По причине того, что высшие карбоновые кислоты входят в состав животных и растительных жиров их называют высшими жирными кислотами.
Примеры предельных высших жирных кислот:
- Каприновая кислота — C9H19COOH,
- Лауриновая кислота — С11Н23СООН,
- Миристиновая кислота — С13Н27СООН,
- Пальмитиновая кислота — С15Н31СООН,
- Стеариновая кислота – С17Н35СООН.
Примеры непредельных высших жирных кислот:
- Олеиновая кислота — С17Н33СООН – имеет одну двойную связь,
- Линолевая кислота – С17Н31СООН — имеет две двойных связи,
- Линоленовая кислота – С17Н29СООН – имеет три двойных связи.
Структурные формулы соединений, в которых присутствуют длинные углеводородный радикалы, часто изображают следующим образом:
В углеводородной цепи атомы углерода расположены не по прямой линии, а виде «змейки». Угол между двумя соседними отрезками такой «змейки» 109 градусов 28 минут. В случае двойной связи угол другой.
В структурной формуле каждая вершина такой «змейки» означает атом углерода, соединённый с двумя атомами водорода. Последний атом углерода соединён с тремя атомами водорода.
При этом сами символы углерода (С) и водорода(Н) не изображаются.
Предельные и непредельные жирные кислоты имеют в значительной степени различные свойства.
Высшие предельные кислоты – воскообразные вещества, непредельные – жидкости (напоминающие растительное масло).
Натриевые и калиевые соли высших жирных кислот называют мылами.
Например:
C17H35COONa – стеарат натрия,
С
Реакции галогенирования
Такие реакции заключаются во введении в молекулу органического вещества галогенов (их атомов), в результате чего образуется связь С-галоген. При взаимодействии алканов с галогенами образуются галогенпроизводные. Данная реакция обладает специфическими особенностями. Она протекает по механизму радикальному, и чтобы ее проинициировать, необходимо на смесь галогенов и алканов воздействовать ультрафиолетовым излучением или же просто нагреть ее. Свойства алканов позволяют реакции галогенирования протекать, пока не будет достигнуто полное замещение на атомы галогена. То есть хлорирование метана не закончится одной стадией и получением метилхлорида. Реакция пойдет далее, будут образовываться все возможные продукты замещения, начиная с хлорметана и заканчивая тетрахлорметаном. Воздействие хлора при данных условиях на другие алканы приведет к образованию различных продуктов, полученных в результате замещения водорода у различных атомов углерода. От температуры, при которой идет реакция, будет зависеть соотношение конечных продуктов и скорость их образования. Чем длиннее углеводородная цепь алкана, тем легче будет идти данная реакция. При галогенировании сначала будет замещаться атом углерода наименее гидрированый (третичный). Первичный вступит в реакцию после всех остальных. Реакция галогенирования будет происходить поэтапно. На первом этапе заместиться только один атом водорода. C растворами галогенов (хлорной и бромной водой) алканы не взаимодействуют.
Химические свойства алканов
При изучении любых органических веществ следует обратить особое внимание на их химические свойства. Они являются показателем химической активности и реакционной способности соединения
Алканы не реагируют с концентрированными серной и азотной кислотами. Они не обесцвечивают окраску растворов окислителей, таких как перманганата калия или бромной воды.
Реакции замещения
Для алканов свойственны реакции такого типа. Разберем подробнее подвиды реакций замещения.
Галогенирование
Алканы взаимодействуют главным образом с бромом и хлором. При взаимодействии метана и хлора на свету получим хлорметан (CH3Cl) и хлороводород. Галогенирование проходит в четыре стадии с поочередным замещением атомов водорода в молекуле метана. На второй, третьей и четвертой стадиях свет уже не является обязательным условием реакции. На второй стадии галогенирования выделяется дихлорметан (CH2Cl2), на третьей — хлороформ (CHCl3), на четвертой — четыреххлористый углерод (CCl4).

Рис. 3. Физические свойства алканов Отметим, что данные реакции идут по цепному свободнорадикальному механизму, который состоит из следующих этапов: инициирование цепи, развитие цепи, обрыв цепи или рекомбинация. Возьмем другой случай: пропан взаимодействует с бромом на свету. В данной ситуации один атом брома будет присоединяться к вторичному атому углерода. В результате получим 2-бромпропан и бромоводород. После того, как все атомы водорода вторичного углерода будут замещены на атомы брома, весь последующий бром может присоединяться к первичным углеродам.
Нитрование (реакция Коновалова)
В данном типе реакций возьмем пропан, который взаимодействует с разбавленной азотной кислотой, находящейся в парах. При температуре в 140 градусов образуется соединение под названием 2-нитропропан и вода соответственно.
Сульфирование
Пропан реагирует с концентрированной, дымящейся серной кислотой при термовоздействии. Принцип действия аналогичен реакции нитрования. В данном случае один атом водорода при вторичном углероде замещается на сульфо-группу. Выделится вода и пропан-2-сульфокислота.
Дегидрирование
От алканов отщепляется два атома водорода. Процесс идет при катализаторе или платины при температуре. На выходе получаем алкен и водород.
Реакции окисления
- Полное сгорание — алканы горят с образованием CO2 и H2O. При этом идет выделение энергии до 900 кДж.
- Неполное сгорание — так сгорает, например, гексан. Он взаимодействует с кислородом и образует CO2, H2O и чистый углерод.
- Окисление в мягких условиях — метан взаимодействует с кислородом в присутствии катализатора и при температуре 200 градусов. В ходе данного взаимодействия могут получиться следующие вещества: метанол (CH3OH), метаналь (CH2O), муравьиная кислота (CH2O2).
Реакции изомеризации
Довольно простой тип реакций алканов. В ходе изомеризации из алканов можно получать их изомеры в присутствии катализатора хлорида алюминия и температуры. Например, из нормального бутана с легкостью получаем метилпропан.
Реакции пиролиза
Разложение алканов при термическом воздействии (более 1000 градусов):
- Этан распадается на углерод и водород;
- Метан разлагается на водород и ацетилен, который впоследствии образует углерод и водород.
Крекинг
Данные реакции идут при термическом воздействии и без доступа воздуха. Алкан буквально делится на две части. Из одной в другую переходит один водород. В итоге мы получаем нормальный алкен и нормальный алкан.
Дегидроциклизация
Реакции, в которых от алканов отщепляется водород, и появляется ароматическая связь. Взаимодействие идет при действии катализаторов платиновой группы и температуры. Из гексана мы получаем данным способом бензол, а из гептана — толуол. Данное взаимодействие, кстати, является промышленным способом получения бензола. Теперь вы знаете обо всех химических способностях алканов. Осталось их тщательно проработать и выучить.
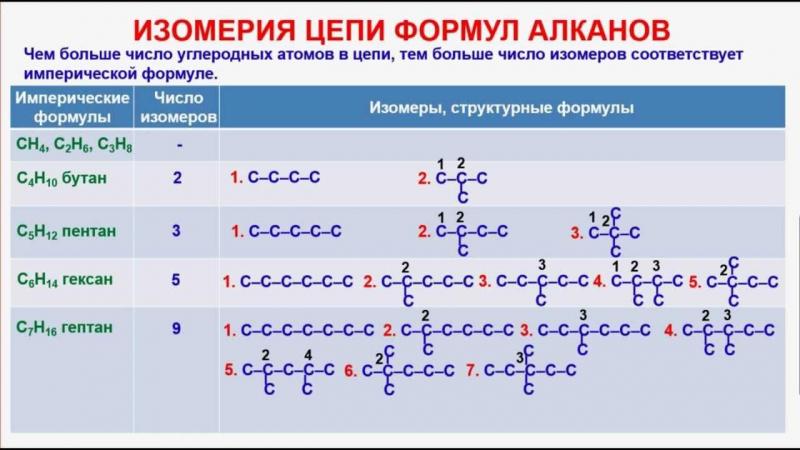
Рис. 4. Изомерия цепи формул алканов
Номенклатура спиртов
Для спиртов действуют рациональная, тривиальная и систематическая номенклатуры.
Рациональная номенклатура строится от метилового спирта или метанола, который в рациональной номенклатуре называется карбинол. Остальные спирты рассматриваются как производные карбинола, к которому присоединены различные радикалы. Названия простых спиртов образуются от названий соответствующих алканов с добавлением суффикса «-ол», и цифрой показывающей место гидроксильной группы в цепи. Например, фенилкарбинол – бензиловый спирт (оксиметилбензол), этилкарбинол – пропиловый спирт (пропанол), винилкарбинол – пропен-2-ол-1 (аллиловый спирт).
Тривиальная номенклатура наиболее широко применяется. Для распространенных спиртов, имеющих простое строение, используют упрощенную номенклатуру: название органической группы преобразуют в прилагательное (с помощью окончания «овый») и добавляют слово «спирт» Метанол (метиловый спирт), пропиловый спирт, группа амиловых спиртов (С5) и т.д. Непредельные спирты практически только и называются тривиальными названиями – аллиловый и пропаргиловый спирты.
Систематическая номенклатура основана на выборе углеродной цепи и характеристике радикала. В систематической номенклатуре для одноатомных спиртов наличие гидроксильной группы указывается суффиксом -ол; для многоатомных -диол, триол и т.д. Суффикс -ол добавляется к названию углеводорода: метан — метанол, этан — этанол и т.д. Гидроксигруппа обозначается после галоидов, углеводородных радикалов и кратных связей. Положение гидроксигруппы обозначается наименьшим значением, если в составе молекулы отсутствует карбонильная и/или карбоксильная группа.
Систематические и тривиальные названия некоторых спиртов.
| Химическая формула спирта | Название по номенклатуре | Тривиальное название |
| CH3OH | Метанол | Древесный спирт |
| C2H5OH | Этанол | Винный спирт |
| C5H11OH | Пентан-1-ол | Амиловый спирт |
| C16H33OH | Гексадекан-1-ол | Цетиловый спирт |
Строение алканов
Основные химические связи у алканов — это ковалентная неполярная связь между атомами углерода (С—С) и ковалентная полярная связь между атомами углерода и водорода (С—Н).
Так как алканы — это предельный класс, делаем вывод, что все связи между атомами являются одинарными, то есть σ-связями.
Разберемся с типом гибридизации атомов углерода в алканах, но сначала вспомним, что такое гибридизация. Упрощенное определение гибридизации звучит так: это смешение различных орбиталей в многоатомной молекуле для выравнивания формы и энергии, которое приводит к изменению формы орбитали. Гибридизация атомов углерода в алканах — sp3. Рассмотрим, как она образуется.
При образовании связи между углеродами происходит смешение их орбиталей — вот так:

В то время как образование связи между углеродом и водородом происходит следующим образом:
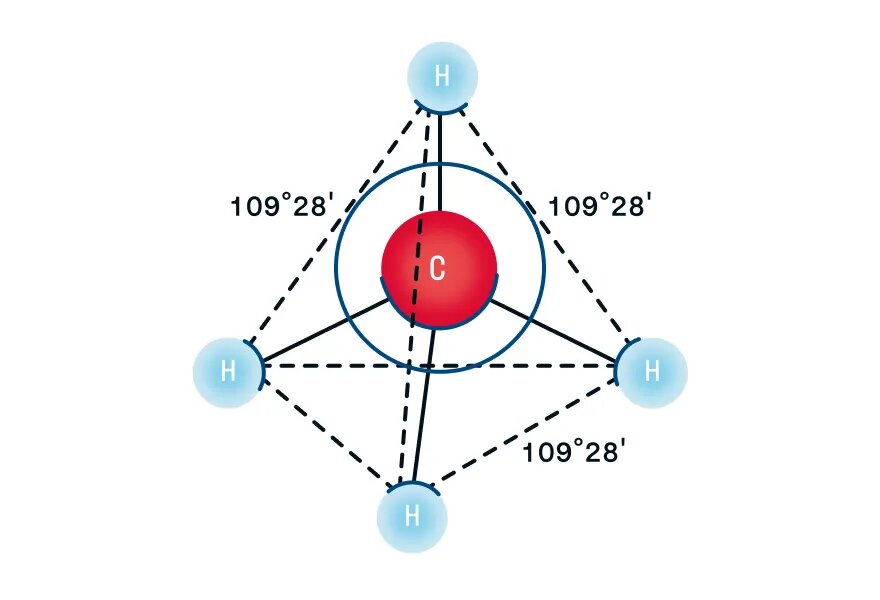
Рассмотрим пространственное строение алканов на примере метана — первого представителя гомологического ряда алканов. При наличии четырех атомов водорода и одного атома углерода в молекуле образуются четыре гибридизованные орбитали, которые взаимно отталкиваются друг от друга, но не произвольно, а под определенным углом. Максимальный угол взаимного отталкивания — это валентный угол, для алканов он равен 109°28′. Таким образом, молекула метана в пространстве выглядит как тетраэдр:
Использование галогенированных производных алканов
Хлороформ CHCl 3 долгое время использовался в качестве анестетика, но его использование было прекращено, поскольку неточная оценка дозы для каждого пациента приводит к смерти. Галотан теперь используется в качестве обезболивающего вещества с безопасностью, и его формула — CHBrCl – CF 3 , 2-бром-2-хлор-1,1,1 трифторэтан, Соединение 1,1,1 трихлорэтан используется в химической чистке.
Фреоны использовались в кондиционировании воздуха и холодильниках, а также в качестве вещества, выбрасываемого для жидкости и парфюмерии, и в качестве очистителя электронных устройств. Фреоны считаются галогенированными производными алканов, которые состоят из (C, F, Cl), как тетрафторметан CF 4, но самый известный из них — дихлордифторметан CF 2 Cl 2 , So фреоны содержат (C, F, Cl).
Фреоны используются в больших количествах из-за их низкой цены, легко сжижаются, не имеют запаха, не ядовиты, негорючие и не вызывают коррозию металлов. Однако фреоны вызывают разрушение озонового слоя, который защищает землю от вредного воздействия ультрафиолетовых лучей. Итак, существует международное соглашение о запрете использования фреонов с 2020 года.
Строение и номенклатура
По определению алканы – предельные или насыщенные углеводороды, имеющие линейную или разветвлённую структуру. Также называются парафинами. Молекулы алканов содержат только одинарные ковалентные связи между атомами углерода. Общая формула –
CnH2n+2.
Чтобы назвать вещество, необходимо соблюсти правила. По международной номенклатуре названия формируются с помощью суффикса -ан. Названия первых четырёх алканов сложились исторически. Начиная с пятого представителя, названия составляются из приставки, обозначающей количество атомов углерода, и суффикса -ан. Например, окта (восемь) образует октан.
Для разветвлённых цепей названия складываются:
- из цифр, указывающих номера атомов углерода, около которых стоят радикалы;
- из названия радикалов;
- из названия главной цепи.
Пример: 4-метилпропан – у четвёртого атома углерода в цепи пропана находится радикал (метил).
Рис. 1. Структурные формулы с названиями алканов.
Каждый десятый алкан даёт называние следующим девяти алканам. После декана идут ундекан, додекан и далее, после эйкозана – генэйкозан, докозан, трикозан и т.д.
Химические свойства алканов
Реакции замещения.
Наиболее характерными для алканов являются реакции свободнорадикального замещения, в ходе которого атом водорода замещается на атом галогена или какую-либо группу.
Приведем уравнения характерных реакций галогенирования:
В случае избытка галогена хлорирование может пойти дальше, вплоть до полного замещения всех атомов водорода на хлор:
Полученные вещества широко используются как растворители и исходные вещества в органических синтезах.
Реакция дегидрирования (отщепления водорода).
В ходе пропускания алканов над катализатором (Pt, Ni, Al2O3, Cr2O3) при высокой температуре (400-600 °C) происходит отщепление молекулы водорода и образование алкена:
Реакции, сопровождающиеся разрушением углеродной цепи. Все предельные углеводороды горят с образованием углекислого газа и воды. Газообразные углеводороды, смешанные с воздухом в определенных соотношениях, могут взрываться.
1. Горение предельных углеводородов — это свободнорадикальная экзотермическая реакция, которая имеет очень большое значение при использовании алканов в качестве топлива:
В общем виде реакцию горения алканов можно записать следующим образом:
2. Термическое расщепление углеводородов.
Процесс протекает по свободнорадикальному механизму. Повышение температуры приводит к гомолитическому разрыву углерод-углеродной связи и образованию свободных радикалов.
Эти радикалы взаимодействуют между собой, обмениваясь атомом водорода, с образованием молекулы алкана и молекулы алкена:
Реакции термического расщепления лежат в основе промышленного процесса — крекинга углеводородов. Этот процесс является важнейшей стадией переработки нефти.
3. Пиролиз. При нагревании метана до температуры 1000 °С начинается пиролиз метана — разложение на простые вещества:
При нагревании до температуры 1500 °С возможно образование ацетилена:
4. Изомеризация. При нагревании линейных углеводородов с катализатором изомеризации (хлоридом алюминия) происходит образование веществ с разветвленным углеродным скелетом:
5. Ароматизация. Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола и его производных:
Алканы вступают в реакции, протекающие по свободнорадикальному механизму, т. к. все атомы углерода в молекулах алканов находятся в состоянии sp3-гибридизации. Молекулы этих веществ построены при помощи ковалентных неполярных С—С (углерод — углерод) связей и слабополярных С—Н (углерод — водород) связей. В них нет участков с повышенной и с пониженной электронной плотностью, легко поляризуемых связей, т. е. таких связей, электронная плотность в которых может смещаться под действием внешних факторов (электростатических полей ионов). Следовательно, алканы не будут реагировать с заряженными частицами, т. к. связи в молекулах алканов не разрываются по гетеролитическому механизму.
Получение и применение в промышленности
В промышленности так получают высокомолекулярный полиэтилен, стереорегулярный изотактический полипропилен, этилен — пропиленовый каучук. Реакционные карбены присоединяются к двойной связи с образованием циклопропанового фрагмента — циклопропанирования. Известны реакции 1,3-диполярного циклоприсоединения и диеновый синтез.
Есть углеводороды, которые легко окисляются и в зависимости от условий реакции окисления образуются различные вещества. Например, при действии KMnO4 (в кислой среде) — смесь карбоновых кислот и кетонов, при действии KMnO4 (слабощелочной раствор) — гликоли (реакция Вагнера), так же действует OsO4 в органических растворителях; HIO4 в присутствии OsO4 расщепляет молекулы этиленовых углеводородов по двойной связи с образованием смеси карбонильных соединений. То же происходит при озонолиза и разложении озонидов.
Реакцию Вагнера и озонирование используют для определения строения этиленовых углеводородов. Действие молекулярного кислорода на этиленовые углеводороды в газовой фазе (150-300 ° С) в присутствии катализатора (Ag) приводит к образованию эпоксисоединений. Таким образом в промышленности синтезируют этилен- и пропиленоксид.
Эпоксиды образуются количественно при воздействии на этиленовых углеводородов надкислот или Н2О2 в ацетонитриле.
При окислении этилена и пропилена кислородом воздуха (CuCl2 и PdCl2) получают соответственно ацетальдегид и ацетон. Известны также методы окисления этиленовых углеводородов, при которых привлекаются двойные связи; например в промышленности газофазным окислением пропилена получают акролеин, в результате окислительного аммонолиза образуется акрилонитрил. Основным способом добывания этиленовых углеводородов является использование нефтепродуктов и природного газа. Из газов жидкофазного и парофазного крекинга комбинацией методов розничной адсорбции, глубокого охлаждения и ректификации под давлением можно выделить индивидуальные этиленовые углеводороды. В лабораторных условиях и в небольшом количестве в промышленности этиленовых углеводородов получают дегидратацией спиртов над Al2O3 или ThO2 при температуре 400-420 ° С или с помощью кислотных дегидратных агентов (H2SO4, ZnCl2, P2O5 и др.).
Метод удобен в случае получения низших олефинов, так как в случае более сложных этиленовых углеводородов реакция часто сопровождается изомеризации. Есть углеводороды (Главным образом цис-изомеры) с заданным положением двойной связи можно получить пиролизом эфиров карбоновых кислот:
разложением четвертичных аммониевых оснований (реакция Гофмана) гидрированием ацетиленовых углеводородов или дегидрированием алканов;
действием алкилиденфосфоренив на карбонильные соединения (реакция Виттига), восстановительным сочетанием альдегидов и кетонов при обработке LiAlH4 и др.
Этиленовые углеводороды — основные исходные реагенты в химической промышленности. Из этилена и пропилена получают различные полимеры и эластомеры, эпоксисоединения, дихлорэтан, этанол, стирен и др.
Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование
Алканы реагируют с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
| Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно. |
При хлорировании алканов с углеродным скелетом, содержащим более 3 атомов углерода, образуется смесь хлорпроизводных.
Например, при хлорировании пропана образуются 1-хлорпропан и 2-хлопропан: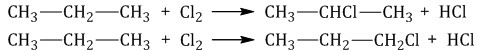 |
Бромирование протекает более медленно и избирательно.
|
Избирательность бромирования: сначала замещается атом водорода у третичного атома углерода, затем атом водорода у вторичного атома углерода, и только затем первичный атом.
С третичный–Н > С вторичный–Н > С первичный–Н |
|
Например, при бромировании 2-метилпропана преимущественно образуется 2-бром-2-метилпропан:
|
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:
Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
1.2. Нитрование алканов
Алканы взаимодействуют с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140оС и под давлением. Атом водорода в алкане замещается на нитрогруппу NO2.
При этом процесс протекает также избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н
|
Например. При нитровании пропана образуется преимущественно 2-нитропропан:
|
Химические свойства алкенов
1. Реакции присоединения
Поскольку двойная связь в молекулах алкенов состоит из одной прочной сигма- и одной слабой пи-связи, они являются довольно активными соединениями, которые легко вступаю в реакции присоединения. В такие реакции алкены часто вступают даже в мягких условиях — на холоду, в водных растворах и органических растворителях.
Гидрирование алкенов
Алкены способны присоединять водород в присутствии катализаторов (платина, палладий, никель):
CH3—СН=СН2 + Н2 → CH3—СН2—СН3
Гидрирование алкенов легко протекает даже при обычном давлении и незначительном нагревании. Интересен тот факт, что для дегидрирования алканов до алкенов могут использоваться те же катализаторы, только процесс дегидрирования протекает при более высокой температуре и меньшем давлении.
Галогенирование
Алкены легко вступаю в реакцию присоединения с бромом как в водном растворе, так и с органических растворителях. В результате взаимодействия изначально желтые растворы брома теряют свою окраску, т.е. обесцвечиваются.
СН2=СН2+ Br2 → CH2Br-CH2Br
Гидрогалогенирование
Как нетрудно заметить, присоединение галогеноводорода к молекуле несимметричного алкена должно, теоретически, приводить к смеси двух изомеров. Например, при присоединении бромоводорода к пропену должны были бы получаться продукты:
Тем не менее в отсутствие специфических условий (например, наличие пероксидов в реакционной смеси) присоединение молекулы галогеноводорода будет происходить строго селективно в соответствии с правилом Марковникова:
Присоединении галогеноводорода к алкену происходит таким образом, что водород присоединяется к атому углерода с большим числом атомов водорода (более гидрированному), а галоген — к атому углерода с меньшим числом атомов водорода (менее гидрированному).
Поэтому:
Гидратация
Данная реакция приводит к образованию спиртов, и также протекает в соответствии с правилом Марковникова:
Как легко догадаться, по причине того, что присоединение воды к молекуле алкена происходит согласно правилу Марковникова, образование первичного спирта возможно только в случае гидратации этилена:
CH2=CH2 + H2O → CH3-CH2-OH
Именно по такой реакции проводят основное количество этилового спирта в крупнотоннажной промышленности.
Полимеризация
Специфическим случаем реакции присоединения можно реакцию полимеризации, которая в отличие от галогенирования, гидрогалогенирования и гадратации, протекает про свободно-радикальному механизму:
Реакции окисления
Как и все остальные углеводороды, алкены легко сгорают в кислороде с образованием углекислого газа и воды. Уравнение горения алкенов в избытке кислорода имеет вид:
CnH2n + (3/2)nO2 → nCO2 + nH2O
В отличие от алканов алкены легко окисляются. При действии на алкены водного раствора KMnO4 обесцвечивание, что является качественной реакцией на двойные и тройные CC связи в молекулах органических веществ.
Окисление алкенов перманганатом калия в нейтральном или слабощелочном растворе приводит к образованию диолов (двухатомных спиртов):
3C2H4 + 2KMnO4 + 4H2O → 3CH2OH–CH2OH + 2MnO2 + 2KOH (охлаждение)
В кислой среде происходит полное разрыв двойной связи с превращение атомов углерода образовывавших двойная связь в карбоксильные группы:
5CH3CH=CHCH2CH3 + 8KMnO4 + 12H2SO4 → 5CH3COOH + 5C2H5COOH + 8MnSO4 + 4K2SO4 + 12H2O (нагревание)
В случае, если двойная С=С связь находится в конце молекулы алкена, то в качестве продукта окисления крайнего углеродного атома при двойной связи образуется углекислый газ. Связано это с тем, что промежуточный продукт окисления – муравьиная кислота легко сама окисляется в избытке окислителя:
CH3CH=CH2 + 2KMnO4 + 3H2SO4 → CH3COOH + CO2 + 2MnSO4 + K2SO4 + 4H2O (нагревание)
При окислении алкенов, в которых атом C при двойной связи содержит два углеводородных заместителя, образуется кетон. Например, при окислении 2-метилбутена-2 образуется ацетон и уксусная кислота.
Окисление алкенов, при котором происходит разрыв углеродного скелета по двойной связи используется для установления их структуры.