Биологическое воздействие
Как и в литосфере, в организме человека кремний – один из топовых макроэлементов (до 4%).
О нехватке вещества сигнализирует следующие факторы:
- Тусклость, ломкость волос, ногтей.
- Сухость кожи.
- Частые ОРВИ, ОРЗ.
- Учащенное сердцебиение.
- Ослабленность скелета (позвоночные боли, остеопороз).
- Бесплодие.
Плюс пониженный иммунитет. У детей – замедление роста и общего развития.
Пополнить запас микроэлемента помогают продукты.
Больше всего вещества в продуктах, богатых клетчаткой:
- Необработанные крупы: рис, овес, ячмень, гречка.
- Все бобовые.
- Орехи, овощи, ягоды, фрукты,
В «животном» сегменте это мясо, яйца, морепродукты, молоко.
Соединения кремния
Ранее мы выяснили, каким элементом является кремний и какими свойствами он обладает. Теперь рассмотрим формулы соединений кремния.
При участии кремния образуется огромное количество различных соединений. Первое место по распространенности занимают кислородные соединения кремния. К данному разряду относится SiO2 и нерастворимая кремниевая кислота.
Кислотный остаток кремниевой кислоты образует различные силикаты (например, CaSiO3 или Al2O3•SiO2). В таких солях и представленных выше соединениях кремния с кислородом элемент имеет типичную для него степень окисления +4.
Также достаточно распространены соли кремния – силициды (Mg2Si, NaSi, CoSi) и соединения кремния с водородом (например, газ силан). Силан, как известно, самовоспламеняется на воздухе с возникновением ослепительной вспышки, а силициды легко разлагаются как при помощи воды, так и различных кислот.
Рассмотрим поподробнее кремний и его соединения, считающиеся самыми распространенными.
Физические свойства[править | править код]
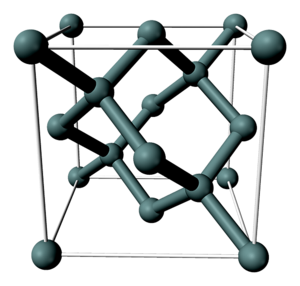
Кристаллическая структура кремния.
Кристаллическая решетка кремния кубическая гранецентрированная типа алмаза, параметр а = 0,54307 нм (при высоких давлениях получены и другие полиморфные модификации кремния), но из-за большей длины связи между атомами Si—Si по сравнению с длиной связи С—С твердость кремния значительно меньше, чем алмаза. Кремний хрупок, только при нагревании выше 800 °C он становится пластичным веществом. Интересно, что кремний прозрачен к инфракрасному излучению начиная с длинны волны 1.1 микрометр. Обладая самым высоким коэффициетом преломления (n = 3,4), прозрачностью, пропусканию инфракрасеых лучей он нашёл широкое применение в изготовлении оптических систем (объективов, биноклей ночного видения, в медицине — контактных линз и т.д.)
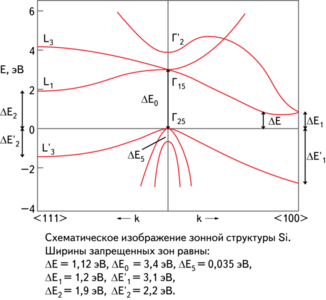
Схематическое изображение зонной структуры кремния
Электрофизические свойстваправить | править код
Элементарный кремний — типичный непрямозонный полупроводник. Ширина запрещенной зоны при комнатной температуре 1,12 эВ, а при Т = 0 К составляет 1,21 эВ . Концентрация носителей заряда в кремнии с собственной проводимостью при комнатной температуре 1,5·1016м-3. На электрофизические свойства кристаллического кремния большое влияние оказывают содержащиеся в нем микропримеси. Для получения монокристаллов кремния с дырочной проводимостью в кремний вводят добавки элементов III-й группы — бора, алюминия, галлия и индия, с электронной проводимостью — добавки элементов V-й группы — фосфора, мышьяка или сурьмы. Электрические свойства кремния можно варьировать, изменяя условия обработки монокристаллов, в частности, обрабатывая поверхность кремния различными химическими агентами.
Подвижность электронов 0,15 м²/в·с (или 1500 cм²/в·с ).
Где используется
Применение кремния определяют свойства. Неметалл хрупок, поэтому непригоден в качестве «скелета» конструкций. Однако эта же характеристика позволяет идеально обрабатывать поверхность кристаллов, что ценят производители электроники.
 Применение кремния
Применение кремния Микроконтроллер 1993 года с УФ стиранием памяти 62E40 европейской фирмы STMicroelectronics. За окошечком виден кристалл микросхемы — кремниевая подложка с выполненной на ней схемой.
Микроконтроллер 1993 года с УФ стиранием памяти 62E40 европейской фирмы STMicroelectronics. За окошечком виден кристалл микросхемы — кремниевая подложка с выполненной на ней схемой.
Промышленность
Кроме IT-индустрии неметалл востребован традиционными сегментами промышленности.

- Металлургия. Технический кремний используется как раскислитель при выплавке чугуна, упрочнитель сплавов.
- Машино-, приборостроение. Сплавы с металлами тверды, тугоплавки. Используются как компоненты турбин, термоэлементы оборудования металлургических комбинатов.
- Электро-, радиотехника. Из неметалла-полупроводника изготавливают фотоэлементы, интегральные схемы, транзисторы, диоды, другую продукцию.
- Органический, неорганический синтез.
- Прозрачность вещества для инфракрасного спектра – главный плюс для производителей оптики.
- Стекольная промышленность. Силикаты – исходник при производстве стекла, хрусталя, керамики, фарфоро-фаянсового ассортимента.
- Песок – компонент строительных материалов (цемента, бетона).
- Почти универсален карбид (кремний + углерод). Соединение закупают металлурги, приборостроители, химпром. Твердое (7 баллов по Моосу) вещество используется как полупроводник широкого диапазона действия и абразив.
- Кремнийорганические соединения закупают производители силиконовой продукции: герметиков, смазок, других изделий.
То есть применение нашлось чистому веществу и соединениям.
Другие сферы
Фармацевты используют кремниевые продукты как базис препаратов для профилактики и лечения атеросклероза, туберкулеза, артрита.
Эстетичные разновидности неметалла – агаты, аметисты, горный хрусталь, опалы, сердолик – закупают ювелиры и собиратели минералогических коллекций.
Лабораторные исследования

В 1822 году в свободном состоянии SiO2 впервые был получен Берцелиусом. В лабораторных условиях аморфный кремний можно получить при нагревании химической смеси, состоящей из диоксида и металлического магния. Для проведения этого опыта компоненты должны быть тщательно измельчены. Под воздействием высоких температур можно наблюдать бурную реакцию. Если всё сделать правильно, то в итоге можно получить аморфный кремний: SiO2 + 2Mg → Si + 2MgO.
В лабораторных условиях также есть возможность задействовать оксид алюминия. Например: 3SiO2 + 4Al → 3Si + 2Al2O3. В промышленных целях использовать дорогостоящий магний и алюминий неэффективно. По этой причине спрос получили более доступные варианты:
- В электрических печах можно коксом восстановить необходимое химическое вещество из оксида. Например: SiO2 + 2С → Si + 2CO. Но во время химической реакции образуется загрязнённое вещество, а всё из-за наличия примесей карбидов кремния. По этой причине SiO2 не может использоваться для производства микросхем.
- Чистый кремний можно получить при условии разложения силана. Химическая формула: SiH4 → Si + 2H2.
- Наиболее чистый SiO2 можно получить в том случае, если прибегнуть к восстановлению тетрахлорида кремния с помощью водорода и высокой температуры (от +1200°C). Но также можно задействовать цинк: SiCl4 + 2Zn → Si + 2ZnCl2.
Литература[править | править код]
- Самсонов. Г. В. Силициды и их использование в технике. Киев, Изд-во АН УССР, 1959. 204 стр. с илл.
- Алёшин Е. П., Алёшин Н. Е. Рис. Москва, 1993. 504 стр. 100 рис.
- Китай ввел пошлины на ввоз поликристаллического кремния «солнечного» качества из США… Под их действие не попадает поликремний «электронного» качества, предназначенный, в частности, для изготовления чипов… // 2014
| H | He | |||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | |
| Uue | Ubn | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | |||||||||||||||||||||||||
| Iа | IIа | IIIб | IIIб: лантаноиды и актиноиды и Суперактиноиды | IVб | Vб | VIб | VIIб | VIIIб | Iб | IIб | IIIа | IVа | Vа | VIа | VIIа | VIIIа | ||||||||||||||||
Инструкция по применению диоксида кремния
Медикаменты, включающие в свой состав рассматриваемое вещество, согласно инструкции, нужно принимать за час до еды. При острых кишечных инфекциях и токсикоинфекциях лекарственный порошок употребляют в объеме 2-3 грамма трижды в сутки. При тяжелом диарейном синдроме количество употребляемого препарата увеличивают до 4-6 грамм и принимают его дважды в день. Диоксид кремния принимают на протяжении 3-5 дней.
В случае отравления лекарственными препаратами или ядовитыми химическими соединениями употребляют по 2-3 грамма трижды в сутки. При аллергиях препарат употребляют по аналогичной методике.
Диоксид кремния в таблетках вреден или нет Е551?
Эта добавка относится к группе безопасных, она разрешена к применению в странах ЕС, Украине и России. Некоторые исследования позволили предположить, что употребление диоксида кремния является профилактикой , однако говорить об этом с полной уверенностью пока нельзя, как и утверждать об абсолютной безопасности Е551 для организма человека.
Диоксид кремния нейтрализует щелочную среду, попадая в организм, он может взаимодействовать с различными веществами. В ходе таких химических реакций возможно образование каких-либо вредных соединений. То есть точно отследить путь, который проходит в организме пищевая добавка Е551, пока не удалось. Поэтому введены ограничения – на 1 кг готового продукта должно приходиться не более 30 г диоксида кремния.
Потенциальный вред Е551 может быть следующим:

Впрочем, вредное воздействие Е551 на организм также не доказано. Кстати, это вещество широко применяется в медицине в качестве сорбента, который связывает и выводит из организма ненужные соединения.
Особенность диоксида кремния заключается в том, что он не взаимодействует с водой. Ограниченное употребление продуктов с пищевыми добавками серьезного вреда, скорее всего, не нанесет, в таком случае диоксид кремния успевает выводиться из организма. Если же в вашем меню постоянно присутствуют продукты, содержащие Е551, то диоксид кремния может накапливаться, и это, возможно, приведет к неприятным последствиям. Лучше ограничить продукты с его содержанием людям, склонным к образованию камней в почках и желчном пузыре.
Полное название Е551 — диоксид кремния аморфного, однако данное вещество имеет много других обозначений, например, «белая сажа», биосил, коэсит, кварц, асил, аэросил, кремнезем.
Он встречается в естественном виде в виде минералов, их смесей, а также им является обычный, привычный нам песок. Различные оксиды кремния — это самые распространенные минералы на нашей планете, они являются частью горных пород, образуют существенную часть мантии и 12% коры Земли.
В кристаллической форме очень твердое, не имеющее цвета и запаха вещество. Для применения в промышленности удобна форма белого сыпучего порошка или шариков. Для применения как пищевую добавку аморфный диоксид кремния синтезируют химическим путем, получая высокочистый продукт.
Важно. Е551 не меняет цвета готовых изделий и никак не влияет на вкусовые ощущения
Е-номер 551 назначен диоксиду кремния по Международной системе классификации INS, согласно ей он является эмульгатором — веществом, сохраняющим структуру изделия. Согласно ГОСТ 32770-2014 эмульгатор — это добавка, предназначенная для создания и/или сохранения однородной смеси двух или более несмешивающихся фаз в пищевом изделии.
Вещество имеет множество модификаций. До сих пор продолжаются открытия разных форм. Например, пару лет назад ученые из США открыли 5 новых его форм.
Для справки. Искусственным путем «белая сажа» была впервые получена в 1953 году ученым Л. Коэсом.
Физико-химические характеристики
Кремний – это неметалл, но выступает как восстановитель либо окислитель:
- Образует сплавы (силициды) с большинством металлов.
- В обычном микроклимате покрывается пленкой-оксидом, становясь инертным.
- Химическая активность почти нулевая, однако растет с ростом температуры.
- Физические и химические свойства формируются строением кристаллической решетки (аллотропным форматом). Например, аморфный неметалл активно впитывает влагу, быстрее взаимодействует при обычной температуре.
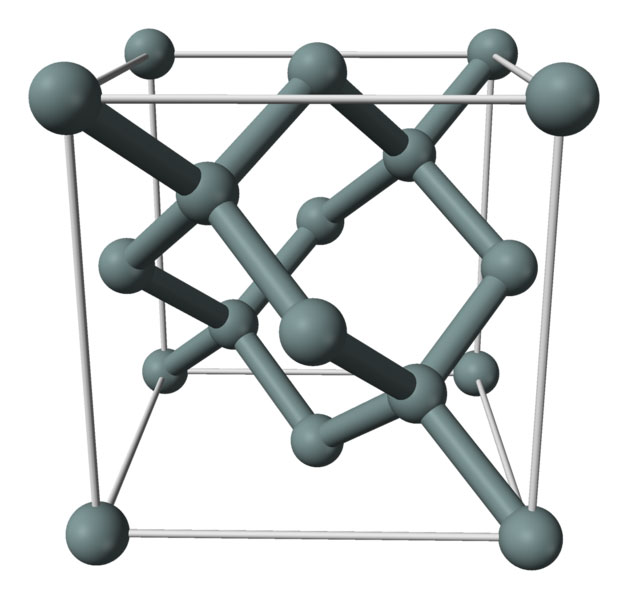
Кристаллическая структура кремния
| Свойства атома | |
| Название, символ, номер | Кремний/Silicium (Si), 14 |
| Атомная масса (молярная масса) | а. е. м. (г/моль) |
| Электронная конфигурация | 3s2 3p2; в соед. 3s 3p3 (гибридизация) |
| Радиус атома | 132 пм |
| Химические свойства | |
| Ковалентный радиус | 111 пм |
| Радиус иона | 42 (+4e), 271 (−4e) пм |
| Электроотрицательность | 1,90 (шкала Полинга) |
| Электродный потенциал | |
| Степени окисления | −4, 0, +2; +4 |
| Энергия ионизации (первый электрон) | 786,0 (8,15) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 2,33 г/см³ |
| Температура плавления | 1414,85 °C (1688 K) |
| Температура кипения | 2349,85 °C (2623 K) |
| Уд. теплота плавления | 50,6 кДж/моль |
| Уд. теплота испарения | 383 кДж/моль |
| Молярная теплоёмкость | 20,16 Дж/(K·моль) |
| Молярный объём | 12,1 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая, алмазная |
| Параметры решётки | 5,4307 Å |
| Температура Дебая | 645 ± 5 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 149 Вт/(м·К) |
| Номер CAS | 7440-21-3 |
В ряде химических процессов кремний ведет себя как металл.
Химические свойства кремния
- Основное химическое свойство кремния – горение в кислороде, в результате которого образуется крайне распространенное соединение – оксид кремния:
Si + O2 → SiO2 (при температуре).
- При нагревании кремний как неметалл образует соединения с различными металлами. Такие соединения называются силицидами. Например:
2Ca + Si → Ca2Si (при температуре).
- Силициды, в свою очередь, без затруднений разлагаются при помощи воды или некоторых кислот. В результате данной реакции образуется особое водородное соединение кремния – газ силан (SiH4):
Mg2Si + 4HCl → 2MgCl2 + SiH4.
- Кремний также способен взаимодействовать с фтором (при нормальных условиях):
Si + 2F2 → SiF4.
- А при нагревании кремний взаимодействует с другими неметаллами:
Si + 2Cl2 → SiCl4 (400–600°).
3Si + 2N2 → Si3N4 (1000°).
Si + C → SiC (2000°).
- Также кремний, взаимодействуя со щелочами и водой, образует соли, называемые силикатами, и газ водород:
Si + 2KOH + H2O → K2SiO3 + H2.
Однако большинство химических свойств данного элемента мы разберем, рассматривая кремний и его соединения, так как именно они являются основными веществами, на которых основано применение и взаимодействие кремния с другими химическими элементами. Итак, какие же соединения кремния являются наиболее распространенными?
Применение вещества

Для промышленности наибольший интерес представляют электрофизические характеристики неметалла. Его монокристаллическая форма является непрямозонным полупроводником. Свойства его определяются примесями, что позволяет получать кристаллы кремния с заданными свойствами.
Так, добавка бора, алюминия, индия дает возможность вырастить кристалл с дырочной проводимостью, а введение фосфора или мышьяка – кристалл с электронной проводимостью.
- Кремний в буквальном смысле слова служит основой современной электротехники. Из него изготавливают транзисторы, фотоэлементы, интегральные схемы, диоды и так далее. Причем функциональность прибора определяет практически всегда только приповерхностный слой кристалла, что обуславливает весьма специфические требования именно к обработке поверхности.
- В металлургии технический кремний применяют и как модификатор сплавов – придает большую прочность, и как компонент – в бронзах, например, и как раскислитель – при производстве чугуна.
- Сверхчистый и очищенный металлургический составляют основу солнечной энергетики.
- Диоксид неметалла встречается в природе в очень разных формах. Его кристаллические разновидности – опал, агат, сердолик, аметист, горный хрусталь, нашли свое место в ювелирном деле. Не столь привлекательные внешне модификации – кремень, песок, кварц, используются и в металлургии, и в строительстве, и в радиоэлектротехнике.
- Соединение неметалла с углеродом – карбид, применяется и в металлургии, и в приборостроении, и в химической промышленности. Он является широкозональным полупроводником, отличается высокой твердостью – 7 по шкале Мооса, и прочностью, что и позволяет применять его в качестве абразивного материала.
- Силикаты – то есть, соли кремниевой кислоты. Неустойчивы, легко разлагаются под действием температуры. Примечательность их в том, что они образуют многочисленные и разнообразные соли. А вот последние являются основой при производстве стекла, керамики, фаянса, хрусталя, цемента и бетона. Можно смело сказать, что современное строительство зиждется на разнообразных силикатах.
- Стекло представляет здесь наиболее интересный случай. Основой его служат алюмосиликаты, но ничтожные примеси других веществ – обычно оксидов, придают материалу массу разных свойств, в том числе и цвет. Керамика – клинкер, фаянс, фарфор, по сути, имеет ту же формулу, хотя и с другим соотношением компонентов, и ее разнообразие тоже поразительно.
- Неметалл обладает еще одной способностью: образует соединения по типу углеродных, в виде длинной цепочки из атомов кремния. Такие соединения носят название кремнийорганических. Сфера их применения не менее известна – это силиконы, герметики, смазки и так далее.
Кремний – очень распространенный элемент и имеет необыкновенно большое значение в очень многих сферах народного хозяйства. Причем активно используется не только само вещество, но все его разнообразные и многочисленные соединения.
http://www.mining-enc.ru/k/kremnij-/
Краткое описание
Оксид кремния (IV) SiO2 представляет собой твёрдое, тугоплавкое кристаллическое вещество, которое не растворяется в воде и не вступает с ней в реакцию. Химический компонент проявляет окислительные свойства. При температуре от +1000°C SiO2 взаимодействует с активными металлами. В этом случае образуется кремний:
- SiO2 + 2Mg = Si + 2MgO.
- 3SiO2 + 4Al = 3Si + 2Al2O3.
При избытке кремния происходит восстановление силицидов. Эта химическая реакция имеет следующую формулу: SiO2 + 4Mg = Mg2Si + 2MgO. Силициум взаимодействует с водородом, а при использовании углерода образуется карборунд: SiO2 + 3C = SiC + 2CO.
Если попробовать сплавить оксид кремния со щелочами, то в итоге можно будет получить силикаты:
- SiO2 + 2NaOH = Na2SiOO3 + H2O.
- SiO2 + CaO = CaSiO3.
- SiO2 + K2CO3 = K2SiO3 + CO2.
- SiO2 + H2O ≠.
При нормальном давлении и температуре воздуха можно выделить три кристаллические модификации SiO2: тридимит, кварц и кристобалит. В каждом случае известны высокотемпературные и низкотемпературные формы. В их основе лежат тетраэдры SiO4, которые соединены четырьмя атомами кислорода в трёхмерной решётке.
Свойства монооксида
На уроках химии можно узнать, что формула оксида кремния выглядит следующим образом — SiO2. Внешне это вещество имеет вязкую консистенцию, больше напоминает смолу. Без какого-либо воздействия оксид кремния отлично сохраняет своё конденсированное состояние, не подвержен окислению. SiO2 не влияет на образование солей, а также не пропускает ток. Получить монооксид кремния можно двумя доступными методами:
- Нагреть кремний до отметки +400°C и выше при недостаточном объёме кислорода. Формула выглядит следующим образом: 2Si + O2 → 2SiO.
- Использование специального метода Чохральского (выращивание монокристаллов путём вытягивания их вверх от свободной поверхности большого объёма расплава) при восстановлении диоксида в условиях высоких температур. Формула: 2SiO2 + Si → 2SiO.
В твёрдом состоянии монооксид представляет собой порошок коричневого цвета. Это химическое вещество обладает высокой прочностью и инертностью при условии взаимодействия с кислотами. Добиться полного растворения монооксида можно только в плавиковой кислоте. Среди основных химических свойств SiO2 можно выделить:
- Монооксид может разлагаться только под воздействием высоких температур. Отобразить эту реакцию можно с помощью следующей формулы: 2SiO → 2Si + О2.
- При нагревании монооксид взаимодействует с СО2. Формула: SiO + CO2 → SiO2 + CO.
- Монооксид кремния вступает в реакцию с парами Н2О, но только при условии нагревания до +500°C. Этот процесс хорошо виден в формуле: SiO + H2O → SiO2 + H2.
- Жидкий хлорид кремния можно получить в том случае, если дополнительно задействовать хлор и нагреть смесь до +800°C. Наглядно эта реакция выглядит так: 2SiO + 4Cl2 → 2SiCl4 + O2.
Характеристика диоксида
Оксид кремния (SiO2) представляет собой кристаллическое тугоплавкое вещество, которое не растворяется в воде. Этот химический компонент не проводит электрический ток. На уроках химии в 8 классе учащимся объясняют, что диоксид входит в состав следующих горных пород:
- Песка.
- Горного хрусталя.
- Яшмы.
- Кварца.
- Агата.
- Аметиста.
Литосфера на 87% состоит из диоксида. Это химическое вещество имеет немолекулярное строение. Атомы кислорода и кремния связаны ковалентным способом. Благодаря этому сформировалась кристаллическая решётка. Диоксид можно получить в лабораторных условиях. Для этого кремний вместе с кислородом нагревают до отметки +500°C: Si + O2 → SiO2.
После воздействия кислот на растворимые силикаты образуется диоксид. В итоге формируется кремниевая кислота, которая распадается на диоксид и воду. Химическая реакция выглядит следующим образом:
- Na2 SiO3 + 2CH3COOH → 2CH3COONa + H2SiO3↓.
- H 2SiO3 → H2O + SiO2.
В нормальных условиях диоксид вступает в реакцию только с плавиковой кислотой. А вот с основными оксидами и щелочами может взаимодействовать только при воздействии высоких температур. Диоксид не реагирует на Н2О. Сегодня это химическое вещество используется для серийного производства силикагеля, стекла и бетона.
Заключение
Итак, мы выяснили, что кремний является важнейшим химическим элементом, широко распространенным в природе. Кремний применяется при строительстве и художественной деятельности, а также незаменим для живых организмов. Многие вещества, начиная от простого стекла и заканчивая ценнейшим фарфором, имеют в своем составе кремний и его соединения.
Изучение химии позволяет познать окружающий наш мир и понять, что не все вокруг, даже самое великолепное и дорогое, настолько таинственно и загадочно, как могло показаться. Желаем успехов в научном познании и изучении такой прекрасной науки, как химия!
Второй по распространённости элемент в земной коре после кислорода (27,6% по массе). Встречается в соединениях.
Аллотропия кремния
Известен аморфный и кристаллический кремний.
Кристаллический
– тёмно-серое вещество с металлическим блеском, большая твёрдость, хрупок, полупроводник; ρ = 2,33 г/см 3 , t°пл. =1415°C; t°кип. = 2680°C.
Имеет алмазоподобную структуру и образует прочные ковалентные связи. Инертен.
Аморфный
— бурый порошок, гигроскопичен, алмазоподобная структура, ρ = 2 г/см 3 , более реакционноспособен.
Получение кремния
1)
Промышленность
– нагревание угля с песком:
2C + SiO 2 t ˚ → Si + 2CO
2)
Лаборатория
– нагревание песка с магнием:
2Mg + SiO 2 t ˚ → Si + 2MgO
Химические свойства
Типичный неметалл, инертен.
Как восстановитель:
1) С кислородом
Si 0 + O 2 t ˚ → Si +4 O 2
2) С фтором (без нагревания)
Si 0 + 2F 2 → SiF 4
3) С углеродом
Si 0 + C t ˚ → Si +4 C
(SiC — карборунд — твёрдый; используется для точки и шлифовки)
4) С водородом не взаимодействует.
Силан (SiH 4) получают разложением силицидов металлов кислотой:
Mg 2 Si + 2H 2 SO 4 → SiH 4 + 2MgSO 4
5) С кислотами не реагирует
(т
олько с плавиковой кислотой
Si
+4
HF
=
SiF
4
+2
H
2
)
Растворяется только в смеси азотной и плавиковой кислот:
3Si + 4HNO 3 + 18HF → 3H 2 + 4NO + 8H 2 O
6) Со щелочами (при нагревании):
Si 0 + 2NaOH + H 2 O t˚ → Na 2 Si +4 O 3 + 2H 2
Как окислитель:
7) С металлами (образуются силициды):
Si 0 + 2Mg t ˚ → Mg 2 Si -4
Применение кремния
Кремний широко используется в электронике как полупроводник. Добавки кремния к сплавам повышают их коррозионную стойкость. Силикаты, алюмосиликаты и кремнезем – основное сырье для производства стекла и керамики, а также для строительной промышленности.
Силан — SiH 4
Физические свойства:
Бесцветный газ, ядовит, t°пл. = -185°C, t°кип. = -112°C.
Получение:
Mg 2 Si + 4HCl → 2MgCl 2 + SiH 4
Химические свойства:
1) Окисление: SiH 4 + 2O 2 t ˚ → SiO 2 + 2H 2 O
2) Разложение: SiH 4 → Si + 2H 2
Оксид кремния (IV) — (SiO 2) n
SiO 2 — кварц, горный хрусталь, аметист, агат, яшма, опал, кремнезём (основная часть песка):
Кристаллическая решётка оксида кремния (IV) – атомная и имеет такое строение:
Al 2 O 3 2SiO 2 2H 2 O — каолинит (основная часть глины)
K 2 O Al 2 O 3 6SiO 2 — ортоклаз (полевой шпат)
Физические свойства:
Твёрдое, кристаллическое, тугоплавкое вещество, t°пл.= 1728°C, t°кип.= 2590°C
Химические свойства:
Кислотный оксид. При сплавлении взаимодействует с основными оксидами, щелочами, а также с карбонатами щелочных и щелочноземельных металлов:
1) С основными оксидами:
SiO 2 + CaO t ˚ → CaSiO 3
2) Со щелочами:
SiO 2 + 2NaOH t ˚ → Na 2 SiO 3 + H 2 O
3) С водой не реагирует
4) С солями:
SiO 2 + CaCO 3 t˚ → CaSiO 3 + CO 2
SiO 2 + K 2 CO 3 t˚ → K 2 SiO 3 + CO 2
5) С плавиковой кислотой:
SiO 2 + 4HF t ˚ → SiF 4 + 2H 2 O
SiO 2 + 6HF t ˚ → H 2 (гексафторкремниевая кислота)
+ 2H 2 O
(реакции лежат в основе процесса травления стекла).
Применение:
1. Изготовление силикатного кирпича
2. Изготовление керамических изделий
3. Получение стекла
Кремниевые кислоты
x SiO 2 y H 2 O
x = 1, y = 1 H 2 SiO 3 — метакремниевая кислота
x = 1, y = 2 H 4 SiO 4 — ортокремниевая кислота и т.д.
Физические свойства:
H 2 SiO 3 — очень слабая (слабее угольной), непрочная, в воде малорастворима (образует коллоидный раствор), не имеет кислого вкуса.
Получение:
Действие сильных кислот на силикаты — Na 2 SiO 3 + 2HCl → 2NaCl + H 2 SiO 3 ↓
Химические свойства:
При нагревании разлагается: H 2 SiO 3 t ˚ → H 2 O + SiO 2
Соли кремниевой кислоты — силикаты
.
1) с кислотами
Na 2 SiO 3 +H 2 O+CO 2 =Na 2 CO 3 +H 2 SiO 3
2) с солями
Na 2 SiO 3 +CaCl 2 =2NaCl+CaSiO 3 ↓
3) Силикаты, входящие в состав минералов, в природных условиях разрушаются под действием воды и оксида углерода (IV) — выветривание горных пород:
(K 2 O Al 2 O 3 6SiO 2)(полевой шпат) + CO 2 + 2H 2 O → (Al 2 O 3 2SiO 2 2H 2 O)(каолинит (глина)) + 4SiO 2 (кремнезём (песок)) + K 2 CO 3
Кремний (Si) — это неметалл, стоящий на 2 месте после кислорода по запасам и нахождению на Земле(25,8% в Земной коре). В чистом виде он практически не встречается, в основном присутствует на планете в виде соединений.


































