Химические свойства
Поскольку он находится в четвертой группе главной подгруппе таблицы Менделеева, то может проявлять как окислительные, так и восстановительные свойства.
Рассмотрим по отдельности каждый вид реакций.
Восстановительные процессы

С простыми веществами:
Si + 2Br2 = SiBr4,
Si + O2 = SiO2.
Со сложными веществами:
Кислоты
3Si + 12HF + 4HNO3 = 3SiF4 + 4NO + 8H2O.
Гидроксиды
Si + 2NaOH + H2O = Na2SiO3 + 2H2.
Окислительные процессы
Он проявляет при взаимодействии с гидридами, металлами, солями, сильными концентрированными кислотами.
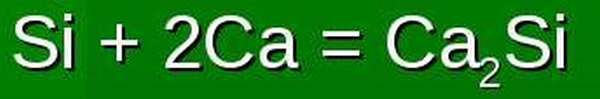
Как правило, в качестве побочных продуктов в таких реакциях выступают окиси неметаллов, сульфаты, нитраты и другие соли, содержащие этот элемент.
Применение
Мини Микроконтроллер 1993 года с УФ стиранием памяти 62E40 европейской фирмы STMicroelectronics За окошечком виден кристалл микросхемы — кремниевая подложка с выполненной на ней схемой.
В настоящее время кремний — основной материал для электроники и солнечной энергетики.
Монокристаллический кремний — материал для рентгеновской оптики преломления — оптика, отличающаяся новыми свойствами и характкристиками, обеспечивающая преломление и фокусировку рентгеновских лучей аналогично тонким линзам. Также применяется для изготовления рентгеновских зеркал, применяемых в рентгеновских микроскопах, телескопах и др.
Иногда кремний (технической чистоты) и его сплав с железом (ферросилиций) используется для производства водорода в полевых условиях.
Соединения металлов с кремнием — силициды, являются широкоупотребляемыми в промышленности (например электронной и атомной) материалами с широким спектром полезных химических, электрических и ядерных свойств (устойчивость к окислению, нейтронам и др.), а также силициды ряда элементов являются важными термоэлектрическими материалами.
Кремний применяется в металлургии при выплавке чугуна, сталей, бронз, силумина и др. (как раскислитель и модификатор, а также как легирующий компонент).
Соединения кремния служат основой для производства стекла и цемента. Производством стекла и цемента занимается силикатная промышленность. Она также выпускает силикатную керамику — кирпич, фарфор, фаянс, стеклокерамику (ситаллы) и изделия из них.
Оптика
Основная статья: Оптические элементы из кремния
Основная статья: Линза из кремния
Плоско-выпуклая линза
Линзы контактные
Оптические элементы из кремния — линзы, призмы, пластинки, изготовленная из однородного кремния, прозрачны для инфракрасно излучения, преломляют Х-лучи и стойкие к Х-излучению.
Линзы контактные
Линзы из органических полимеров дают возможность создавать недорогие асферические линзы с помощью литья. В области офтальмологии созданы мягкие контактные линзы. Их производство основано на применении оптическиих полимерных материалов материалов (ОПМ), имеющих бифазную природу, сочетающих фрагменты кремний-органического или кремний-фторорганического полимера силикона и гидрофильного полимера гидрогеля.
Линзы из кремния
Линза преломления ретгеновских лучей
Линзы из кремния или рентгеновская оптика преломления — линзы, изготовленные из однородного кремния, прозрачные для инфракрасного излучения, рентгеновсого излучения, преломляющие Х-лучи.
В настоящее время нашли применение линзы из кремния
Это связано с современным уровнем технологий обработки твёрдых кристаллов и самое важное, кремний сочетает сверхвысокую дисперсию с самым большим абсолютным значением коэффициента преломления n=3,4 в диапазоне ИК-излучения; линзы из кремния прозрачны к Х-лучам и способны их преломлять, фокусировать (мягкие и жёсткие Х-лучи), что в последнее время находят широкое применение в микроскопии, телескопии, вытесняя рентгеновскую дорогостоящую оптику с применением зеркал и оптических систем «скользящего» преломления Х-лучей. Они полностью непрозрачны в видимом диапазоне спектра
Кроме этого кремний обладает способностью создавать материалы, имеющих бифазную природу, сочетающих фрагменты кремний-органического или кремний-фторорганического полимера силикона и гидрофильного полимера гидрогеля. Что делает его самым перспективным в изготовлении мягких контактных линз.
Биологическая роль
Для некоторых организмов кремний является важным биогеным элементом. Он входит в состав опорных образований у растений и скелетных — у животных. В больших количествах кремний концентрируют морские организмы — диатомовые водоросли, радиолярии, губки. Большие количества кремния концентрируют хвощи и злаки, в первую очередь — подсемейства Бамбуков и Рисовидных, в том числе — рис посевной. Мышечная ткань человека содержит (1-2)·10-2% кремния, костная ткань — 17·10-4%, кровь — 3,9 мг/л. С пищей в организм человека ежедневно поступает до 1 г кремния.
Соединения кремния относительно нетоксичны. Но очень опасно вдыхание высокодисперсных частиц как силикатов, так и диоксида кремния, образующихся, например, при взрывных работах, при долблении пород в шахтах, при работе пескоструйных аппаратов и т. д. Микрочастицы SiO2, попавшие в лёгкие, кристаллизуются в них, а возникающие кристаллики разрушают лёгочную ткань и вызывают тяжёлую болезнь — силикоз. Чтобы не допустить попадания в лёгкие опасной пыли, следует использовать для защиты органов дыхания респиратор.
Краткое описание
От 26 до 30% от общей массы земной коры состоит из гидроксида кремния (общая формула — H2SiO3). В морской воде концентрация этого вещества достигает отметки 3 мг/л. По уровню распространённости в литосфере кремний находится на втором месте после О2. Наиболее востребованная форма H2SiO3 — кремнезём, который является диоксидом. Химические и физические свойства этого материала повлияли на его распространённость в промышленности.
H2SiO3 — неметалл, который в зависимости от созданных условий может проявлять не только кислотные, но и основные характеристики. Кремний является полупроводником, из-за чего активно используется в электротехнике. От аллотропного состояния зависят химические и физические свойства H2SiO3. Чаще всего приходится работать с кристаллической формой неустойчивого вещества, так как его характеристики наиболее востребованы в народном хозяйстве.
Номенклатура кремниевой кислоты (химическая формула — nSiO2•mH2O) включает в себя различные подвиды. Условное обозначение химического состава выглядит так:
- Дикремниевые. Речь идёт о H6Si2O7, H2Si2O5, H10Si2O9. При температуре +20 °C показатель растворимости в Н2О составляет 2.93 моль/л (-4 степень).
- Ортокремниевые (H4SiO4). Метакремниевая и ортокремниевая кислоты являются наиболее распространёнными химическими веществами этого вида.
- Пирокремниевые соединения (H6Si2O7).
Наиболее распространённая форма кремния представляет собой тёмно-серый порошок. Это вещество имеет алмазоподобную кристаллическую решётку, но между атомами слишком длинная связь, с чем и связана хрупкость неметалла.
Соли кремниевых кислот обозначаются только как силикаты. В состав поликремневых кислот входят специфические структурные звенья, которые соединены между собой в сложные разветвлённые, а также линейные цепи. В графических формулах и отдельных характеристиках присутствуют серьёзные различия, но все виды этих химических соединений обладают тетраэдрическим принципом строения. Гидрат окиси кремния (кремнезём) обязательно присутствует в составе экзоскелетов одноклеточных простейших.
Диоксид кремния (кремнезём)
Ключевые слова конспекта: оксид кремния IV, диоксид кремния, кремнезём, силикаты, горный хрусталь, кварц, аметист, агат, яшма, сердолик.
Кремний, подобно углероду, образует оксид кремния (IV) SiO2 (диоксид кремния) и оксид кремния (II) SiO (монооксид кремния). Одним из наиболее распространённых соединений кремния является оксид кремния (IV).
Оксид кремния (IV) (диоксид кремния, кремнезём SiO2) – вещество немолекулярного строения, его кристаллическая решётка атомная. Каждый атом кремния образует четыре ковалентные связи в тетраэдрических направлениях с соседними атомами. Кристаллы SiO2 состоят из цепочек тетраэдров, связанных между собой через атомы кислорода.
Схематически строение (SiO2)n в плоскостном изображении можно представить так:
Кремний образует высший оксид с атомной кристаллической решёткой, в то время как высший оксид углерода – молекулярное вещество. Отсюда их разительное отличие в свойствах: оксид углерода (IV) – газ (при обычных условиях), оксид кремния (IV) – прозрачное, бесцветное, кристаллическое, нерастворимое в воде, тугоплавкое (t°пл. = 1728 °С) вещество.
В кристаллическом виде реакционная способность диоксида кремния низкая. В аморфном состоянии он более активен.
Диоксид кремния является кислотным оксидом
Важно отметить: он не реагирует с водой! Кремниевую кислоту нельзя получить непосредственной гидратацией диоксида кремния
Мелко раздробленный диоксид кремния SiO2 реагирует с кипящими водными растворами и расплавами щелочей с образованием силикатов: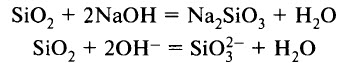
При нагревании диоксид кремния реагирует с карбонатами щелочных и щёлочноземельных металлов, вытесняя более летучий диоксид углерода СO2:![]()
В SiO2 содержится кремний в высшей степени окисления, следовательно, SiO2 может выступать в роли окислителя. Окислительные свойства для диоксида кремния SiO2 не характерны, но возможны. Пример такой реакции – восстановление Si из SiO2 магнием: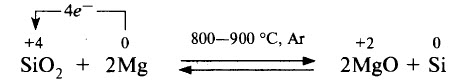
На долю свободного диоксида кремния приходится приблизительно 12% от всей массы земной коры. Химически чистый оксид кремния (IV) встречается в виде горного хрусталя и кварца, а окрашенный примесями – в виде аметиста, агата, яшмы, сердолика и других минералов. Диоксид кремния встречается и в аморфном состоянии – инфузорная земля – пористая мелкозернистая масса, образованная из остатков мелких организмов. Из мелких зёрен кварца состоит обыкновенный песок. Его желтоватый или красноватый цвет говорит о наличии в нём соединений железа.
Конспект урока по химии «Диоксид кремния (кремнезём)». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
Ещё конспекты по теме «Углерод и кремний«:
Применение силана
 Назад к списку статей
Назад к списку статей
Силан – водородное соединение кремния — SiH4. Бесцветный газ с характерным неприятным запахом. Он получается из силицидов различных металлов при взаимодействии их с кислотами.
Этот кремневодород никогда не образуется как моносилан. Вместе с ним получаются ди- и трисиланы, где атомы кремния связаны между собой.
Как и моносилан, дисилан – газообразное вещество, остальные представители силанов – летучие ядовитые жидкости, а высшие члены семейства – твердые вещества.
Чем интересны силаны?
Силаны делятся на три вида:
- 1.Силаны из первой группы могут вступать в реакции с неорганическими поверхностями, в качестве соединяющего вещества между разными по составу материалами.
- 2.Нефункциональные силаны, имеющие только одну активную группу, способны вступать в реакции с неорганическими веществами. Они нашли применение в специфической трансформации поверхностей материалов.
- 3.Есть еще одна группа силанов – бифункциональные, так называемые сшивающие вещества. Они применяются в сталелитейном и шинном производстве.
Сферы применения
Силаны можно назвать одними из основных современных стратегических материалов, которые нашли применение в разных сферах:
- Добыча и разработка нефти и газа. Они используются при эксплуатации и ремонте нефтяных и газовых скважин в качестве гидрофобизаторов, смесей для тампонажа, пеногасителей и т. д
- Транспортировка природного газа. Их используют в качестве защитных покрытий подземных емкостей, а также в качестве гидравлических жидкостей и термостойких лаков.
- Строительные материалы: гидрофобизаторы, герметики, битумные смеси, битумная кровля.
- Строительство дорог: полимерные защитные составы, битумные эмульсии.
- Химическая промышленность: производство пластмасс, технических масел, смазок и резины, антиадгезивов.
- Сталелитейная промышленность: в качестве связующего материала в изготовлении керамических форм для точного литья и как термоустойчивые краски.
- Автомобилестроение: термоустойчивые лаки, герметики, технические масла и смазки.
- Электротехническая индустрия: электроизоляционные, пропиточные и покровные материалы.
- Текстильное производство: материалы для пеногашения, замасливания.
- Парфюмерная индустрия: в качестве компонентов косметических средств – кремов, помад для губ и т.д.
Этим перечислением сферы применения силанов не ограничиваются. Так, например, сегодня трудно представить себе современную стоматологию без использования силанов.
Они применяются в фиксации и реставрационном керамическом ремонте коронок и мостовидных протезов. А также они незаменимы в изготовлении ортопедических конструкций.
Силаны отлично зарекомендовали себя как композитные пломбировочные материалы.
Моносилан кремния применяется в производстве поликристаллического кремния и в полупроводниковом производстве. Его применяют как исходный материал для получения поликристаллических стержней кремния, который обладает высокой чистотой и используется в современной электронной промышленности.
Преимущества силанов
Силаны, имеют целый ряд важнейших эксплуатационных качеств:
- Способность сохранять высокую функциональную активность в большом температурном диапазоне.
- Незначительный температурный градиент вязкости.
- Оптимальную степень инертности к коррозии.
- Высокую температуру вспышки.
- Уникальный гидрофобный эффект.
- Максимальную электроизоляционную стойкость.
- Высокую термостойкость.
- Высокую биологическую инертность.
- Почти полное отсутствие окисляемости.
Как мы видим, в современном мире роль силанов трудно переоценить. Сфера применения силанов постоянно расширяется, что делает эти материалы универсальными.
Сферы применения
Гидроксид кремния получил большой спрос в промышленности благодаря своим электрофизическим характеристикам. Свойства этого неметалла зависят от примесей. Например, если добавить в состав индий, бор или алюминий, то в итоге можно будет вырастить кристалл дырочной проводимости. Задействовав мышьяк либо фосфор можно получить материал с хорошей электронной проводимостью.
H2SiO3 активно используется в следующих отраслях:

- Очищенный кремний применяется в качестве основы для добычи солнечной энергии.
- H2SiO3 получил большой спрос в электронике. Из кремния на серийном уровне изготавливают фотоэлементы, транзисторы, диоды, интегральные схемы. Итоговая функциональность прибора зависит от характеристик поверхностного слоя кристалла.
- Кремний используют в качестве модификаторов сплавов в металлургической отрасли. H2SiO3 выступает в роли раскислителя при производстве чугуна.
- В природе встречается диоксид кремния, который может иметь самую разную форму. Например, агат, опал, аметист, сердолик, горный хрусталь. Эти кристаллические разновидности H2SiO3 используются в ювелирном деле. В металлургии, радиоэлектронике и строительстве применяются песок, кремень и кварц.
- Силикаты H2SiO3 отличаются своей неустойчивостью, к тому же они легко растворяются под действием высоких температур. Образуемые соли используются для производства керамики, стекла, хрусталя, фаянса, бетона и цемента. Благодаря этому можно с уверенностью сказать, что современное строительство основано на разнообразных силикатах.
- При соединении кремния с углеродом образуется карбид, который используется в приборостроении, металлургии, а также в химической отрасли. Это вещество относится к категории широтно-зональных полупроводников. Карбид обладает высокой твёрдостью — 7 баллов по шкале Мооса, за счёт чего его часто используют в качестве надёжного абразивного материала.
Гидроксид кремний является распространённым химическим элементом и имеет большое значение во многих отраслях народного хозяйства. При этом спрос получило не только само вещество, но и его многочисленные соединения.
Как связаны щелочи с основаниями?
Щелочи – это небольшая группа неорганических веществ, относящихся к основным гидроксидам или основаниям. Для начала разберемся, какие вещества можно называть основаниями. Основания – это вещества, содержащие гидроксо-группу (‒OH), которая в неорганической химии (в случае с основаниями) пишется в конце молекулы, например: NaOH, Fe(OH)2, Ba(OH)2, но это определение не точное, ведь Fe(OH)3 и Zn(OH)2 имеют сходную формулу, однако, основаниями не являются. Точнее будет сказать, что основания – это гидроксиды, в которых металл находится в степени окисления «+1» или «+2» (кроме цинка и бериллия, образующих в степени окисления «+2» амфотерные оксиды и гидроксиды).
Таблица 1. – Основания и амфотерные гидроксиды
|
Это основания: |
Это НЕ основания: |
|
NaOH KOH Mg(OH)2 Ca(OH)2 Fe(OH)2 |
Al(OH)3 Fe(OH)3 Cr(OH)3 Zn(OH)2 Be(OH)2 |
|
Потому что содержат металл в степени окисления «+1» или «+2» |
Так как в этой группе есть гидроксиды, имеющие металл в степени окисления «+3», и два исключения — Zn(OH)2 и Be(OH)2. Все приведенные выше вещества являются амфотерными гидроксидами, а не основаниями |
Подробнее об отличиях понятий «гидроксиды» и «основания» можно прочитать в статье «Классификация гидроксидов и оснований»
Кроме отличий в степени окисления, основания и амфотерные гидроксиды отличаются так же по реакционной способности. Так, амфотерные гидроксиды могут реагировать как с кислотами, так и с основаниями, а основания могут реагировать с кислотами, но не могут реагировать с другими основаниями. Подробнее о химических свойствах амфотерных гидроксидов можно прочитать в статье «Амфотерные гидроксиды. Получение, химические свойства, образование средних и комплексных солей»
Получение
Кремнезем из песков получают непосредственно из карьеров.

Таким же способом получают диатомит или кизельгур с использованием экскаваторов и подобного оборудования.
Аморфный кремнезем получают из водных растворов силиката щелочного металла (например, натрия Na) нейтрализацией кислотой, например серной кислотой H2ЮЗ4, соляная кислота HCl или диоксид углерода CO2.
Если конечный pH раствора нейтральный или щелочной, получается осажденный диоксид кремния. Если pH кислый, получается силикагель.
Коллоидный диоксид кремния получают путем сжигания летучего соединения кремния, обычно тетрахлорида кремния SiCl.4. Осажденный диоксид кремния получают из водного раствора силикатов, к которому добавлена кислота.
Коллоидный кремнезем — это стабильная дисперсия частиц аморфного кремнезема коллоидного размера в водном растворе.
Продукты богатые моносахаридами
Лидерами по содержанию простых углеводов являются сиропы, шоколад, мучные изделия, безалкогольные сладкие напитки, крупы, бобовые, злаковые.
Содержание моносахаридов в продуктах растительного происхождения (на 100 грамм продукта):
- в меде – 80 грамм;
- в финиках – 69 грамм;
- в изюме – 66 грамм;
- в горохе – 64 грамма;
- в сухих яблоках, грушах – 59-62 грамма;
- в сухих инжире, персике, черносливе – 58 грамм;
- в урюке – 53 грамма;
- в кураге – 51 грамм;
- в картофеле – 18 грамм;
- в свекле – 18 грамм;
- в моркови – 8-9 грамм;
- в винограде – 7-8 грамм;
- в бананах – 6 грамм;
- в сливах – 5 грамм;
- в вишне – 4 грамма;
- в кукурузе – 3,5 грамма;
- в смородине (белой, красной) – 3 грамма;
- в яблоках, грушах – 2,5 грамма;
- в красном сладком перце – 2 грамма;
- в свежей белокочанной капусте – 2 грамма;
- в виноградном соке – 7 грамм;
- в соке манго – 5,5 грамма;
- в апельсиновом соке – 2,5 грамма.
У каких продуктов богатое содержание моносахаридов (на сто грамм):
- у сахара-песка – 99,8 г;
- у леденцовой карамели – 96 г;
- у муки из риса, пастилы, зефира, жевательного мармелада – 80 г;
- у пряников – 75 г;
- у сахарного печенья, варенья из клубники, риса – 74 г;
- у муки из кукурузы – 72 г;
- у баранок сушек, крупы из кукурузы – 71 г;
- у манки, гречки, пшеничной крупы, макарон, варенья из малины, пшеничной муки – 70 г;
- у пшеничной крупы, сдобного печенья – 68 г;
- у перловой крупы, сдобных сухарей, пшенной крупы – 67 г;
- у муки из ржи, отрубей овса – 66 г;
- у ячневой крупы, овсяной муки, толокна – 65 г;
- у бисквитных пирожных, вафель – 63 г;
- у риса, геркулеса – 62 г;
- у овсяной крупы, пшеницы, шоколадных конфет – 60 г;
- у сгущенного молока – 57 г;
- у ячменя, гречихи, ржи, сдобных булочек – 56 г;
- у овса – 55 г;
- у подсолнечной халвы – 54 г;
- у сухого молока – 53 г;
- у песочного пирожного – 52 г;
- у батона – 51 г;
- у молочного шоколада – 50 г.
Моносахариды не содержатся в клетках животных организмов, или их там незначительное количество. Например, устрицы содержат на 100 г всего около одного гр. глюкозы, желток яйца курицы – 0,2 г, коровье молоко средней жирности – 0,01 г.
В индустрии косметики и личной гигиены
Он используется во множестве продуктов: в пудрах для лица, тенях для век, подводках для глаз, губных помадах, румянах, средствах для снятия макияжа, пудрах, пудрах для ног, красках для волос и отбеливателях.
Также в маслах и солях для ванн, пенных ваннах, кремах для рук и тела, увлажняющих средствах, дезодорантах, кремах или масках для лица (кроме кремов для бритья), парфюмерии, лосьонах и очищающих кремах.
Также в кремах для ночного увлажнения, лаках и красках для ногтей, освежающих лосьонах для кожи, тониках для волос, зубной пасте, кондиционерах для волос, гелях и кремах для загара.
Химические свойства
H2SiO3 не имеет выраженного запаха, а также плохо растворяется в воде. Кислоты кремния существенно отличаются от остальных органических веществ. Основные различия:
- кислоты не диссоциируют;
- при взаимодействии с Н2О образуется коллоидный раствор;
- кремниевые кислоты не влияют на окраску индикатора.

Растворить nSiO2∙mH2O можно в растворах щелочей и специальных расплавах. В итоге образуются силикаты: H2SiO3 + 2KOH → K2SiO3 + 2H2O. Все соединения с кремнием реагируют с плавиковой кислотой, например, H2SiO3 + 6HF → H2SiF6 + 3H2O → SiF4 + 2HF + 3H2O. В результате воздействия соляной кислоты на кремний происходит образование сложного соединения под названием хлорсилан, а также выделяется газ (водород).
Если для проведения химической реакции используется кремний плюс гидроксид натрия, тогда результат будет следующим: Si + NaOH → Na4SiO4 + 2H2. Свойства кремниевых кислот повлияли на то, что эти химические вещества активно используются для серийного производства керамических покрытий и прочных изделий из керамики. nSiO2∙mH2O применяется для изготовления силикагеля (SiOH), стекла и различных фильтров.
Кристаллический кремний
Кремний в данной модификации является темно-серым достаточно твердым и хрупким веществом со стальным блеском. Такой кремний является полупроводником; его полезное свойство заключается в том, что, в отличие от металлов, его электропроводность увеличивается при повышении температуры. Температура плавления такого кремния составляет 1415 °С. К тому же, кристаллический кремний не способен растворяться в воде и различных кислотах.
Применение кремния и его соединений в кристаллической модификации невероятно многообразно. Например, кристаллический кремний входит в состав солнечных батарей, устанавливаемых на космических кораблях и крышах домов. Кремний является полупроводником и способен преобразовывать солнечную энергию в электрическую.
Помимо солнечных батарей, кристаллический кремний используется для создания многих электронных приборов и кремнистых сталей.
Преимущества и недостатки
Как и любое другое химическое вещество H2SiO3 обладает положительными и негативными характеристиками, которые повлияли на то, в каких отраслях используется этот элемент. Среди основных преимуществ силициума можно выделить:
- Образование большого количества соединений с многочисленными полезными свойствами. Например, силициды, силаны, диоксиды и силикаты. H2SiO3 отличается тем, что с его участием можно образовывать различные твёрдые растворы практически бесконечно. Это свойство получило большой спрос в промышленности, так как при правильном применении можно получать различные виды камня, стекла и керамики.
- Востребованность H2SiO3 связана с его доступностью. В природе это химическое вещество нельзя встретить в свободном виде, но технология его получения отличается своей простотой.
- H2SiO3 относится к категории нетоксичных элементов, за счёт чего его можно использовать в любой промышленности.
- Высокие полупроводниковые свойства. Кремний получил спрос в радио- и электротехнике.
Силициум нельзя использовать для возведения несущих конструкций
Это химическое вещество применяется для качественной обработки поверхности кристаллов, что очень важно в сфере приборостроения
В различных приложениях
Кремнезем или SiO2 он имеет широкий спектр функций, например, он служит в качестве абразива, абсорбента, предотвращения слеживания, наполнителя, глушителя и способствует суспендированию других веществ, среди многих других способов использования.
Он используется, например:
-При производстве стекла, керамики, огнеупоров, абразивов и жидкого стекла.
-Обесцвечивание и очистка масел и нефтепродуктов
-В литейных формах
-Как предотвращает слеживание порошков всех видов
-В качестве пеногасителя
-Для фильтрации жидкостей, таких как растворители для химической чистки, вода в плавательных бассейнах, городские и промышленные сточные воды.
-При производстве теплоизоляции, огнестойкого кирпича и огнестойких и кислотостойких упаковочных материалов.
-В качестве наполнителя при производстве бумаги и картона, чтобы сделать их более прочными.
-Как наполнитель красок для улучшения их текучести и цвета.
-В материалах для полировки металлов и дерева, так как придает абразивность
-В лабораториях химического анализа в хроматографии и в качестве абсорбента
-Как средство против слеживания в инсектицидных и агрохимических формулах, для измельчения воскообразных пестицидов и в качестве носителя активного соединения
-Как носитель катализатора
-Как наполнитель для армирования синтетических каучуков и каучуков.
-Как переносчик жидкостей в кормах для животных
-В печатных красках
-В качестве осушителя и адсорбента в виде силикагеля.
-Как добавка в цемент
-Как любимый песок
-В изоляторах для микроэлектроники
-На термооптических переключателях
Физические свойства
Перед использованием любого химического элемента нужно в первую очередь изучить его характеристики. Кремний обладает следующими физическими свойствами:
- Кристаллическая решётка H2SiO3 практически не отличается от алмаза. В этом случае углерод и кремний являются практически одинаковыми, но расстояние между атомами разное. Тип решётки — кубическая гранецентрированная.
- Кремний существует в виде двух аллотропных модификаций: кристаллической, аморфной.
- H2SiO3 закипает при температуре +3250 °C.
- Повышенная хрупкость. Под воздействием высоких температур H2SiO3 приобретает пластичность.
- Химический элемент обладает полупроводниковыми свойствами, которые могут варьироваться при добавлении различных агентов.
- H2SiO3 плавится при температуре +1415 °C.
- Плотность химического вещества составляет 2.33 г/см3.
- Гидроксид кремния не растворяется в воде, кислотах и органических жидкостях.

Физические свойства H2SiO3 повлияли на то, что это вещество используют в различных отраслях современной промышленности.
Заключение
Итак, мы выяснили, что кремний является важнейшим химическим элементом, широко распространенным в природе. Кремний применяется при строительстве и художественной деятельности, а также незаменим для живых организмов. Многие вещества, начиная от простого стекла и заканчивая ценнейшим фарфором, имеют в своем составе кремний и его соединения.
Изучение химии позволяет познать окружающий наш мир и понять, что не все вокруг, даже самое великолепное и дорогое, настолько таинственно и загадочно, как могло показаться. Желаем успехов в научном познании и изучении такой прекрасной науки, как химия!


































