Электронные формулы элементов первых четырех периодов
Рассмотрим заполнение электронами оболочки элементов первых четырех периодов. У водорода заполняется самый первый энергетический уровень, s-подуровень, на нем расположен 1 электрон:
+1H 1s1 1s
У гелия 1s-орбиталь полностью заполнена:
+2He 1s2 1s
Поскольку первый энергетический уровень вмещает максимально 2 электрона, у лития начинается заполнение второго энергетического уровня, начиная с орбитали с минимальной энергией — 2s. При этом сначала заполняется первый энергетический уровень:
+3Li 1s22s1 1s 2s
У бериллия 2s-подуровень заполнен:
+4Be 1s22s2 1s 2s
Далее, у бора заполняется p-подуровень второго уровня:
+5B 1s22s22p1 1s 2s 2p
У следующего элемента, углерода, очередной электрон, согласно правилу Хунда, заполняет вакантную орбиталь, а не заполняет частично занятую:
+6C 1s22s22p2 1s 2s 2p
Попробуйте составить электронную и электронно-графическую формулы для следующих элементов, а затем можете проверить себя по ответам конце статьи:
5. Азот
6. Кислород
7. Фтор
У неона завершено заполнение второго энергетического уровня:
+10Ne 1s22s22p6 1s 2s 2p
У натрия начинается заполнение третьего энергетического уровня:
+11Na 1s22s22p63s1 1s 2s 2p 3s
От натрия до аргона заполнение 3-го уровня происходит в том же порядке, что и заполнение 2-го энергетического уровня. Предлагаю составить электронные формулы элементов от магния до аргона самостоятельно, проверить по ответам.
8. Магний
9. Алюминий
10. Кремний
11. Фосфор
12. Сера
13. Хлор
14. Аргон
А вот начиная с 19-го элемента, калия, иногда начинается путаница — заполняется не 3d-орбиталь, а 4s. Ранее мы упоминали в этой статье, что заполнение энергетических уровней и подуровней электронами происходит по энергетическому ряду орбиталей, а не по порядку. Рекомендую повторить его еще раз. Таким образом, формула калия:
+19K 1s22s22p63s23p64s11s 2s 2p3s 3p4s
Для записи дальнейших электронных формул в статье будем использовать сокращенную форму:
+19K 4s1 4s
У кальция 4s-подуровень заполнен:
+20Ca 4s2 4s
У элемента 21, скандия, согласно энергетическому ряду орбиталей, начинается заполнение 3d-подуровня:
+21Sc 3d14s2 4s 3d
Дальнейшее заполнение 3d-подуровня происходит согласно квантовым правилам, от титана до ванадия:
+22Ti 3d24s2 4s 3d
+23V 3d34s2 4s 3d
Однако, у следующего элемента порядок заполнения орбиталей нарушается. Электронная конфигурация хрома такая:
+24Cr 3d54s1 4s 3d
В чём же дело? А дело в том, что при «традиционном» порядке заполнения орбиталей (соответственно, неверном в данном случае — 3d44s2) ровно одна ячейка в d-подуровне оставалась бы незаполненной. Оказалось, что такое заполнение энергетически менее выгодно. А более выгодно, когда d-орбиталь заполнена полностью, хотя бы единичными электронами. Этот лишний электрон переходит с 4s-подуровня. И небольшие затраты энергии на перескок электрона с 4s-подуровня с лихвой покрывает энергетический эффект от заполнения всех 3d-орбиталей. Этот эффект так и называется — «провал» или «проскок» электрона. И наблюдается он, когда d-орбиталь недозаполнена на 1 электрон (по одному электрону в ячейке или по два).
У следующих элементов «традиционный» порядок заполнения орбиталей снова возвращается. Конфигурация марганца:
+25Mn 3d54s2
Аналогично у кобальта и никеля. А вот у меди мы снова наблюдаем провал (проскок) электрона — электрон опять проскакивает с 4s-подуровня на 3d-подуровень:
+29Cu 3d104s1
На цинке завершается заполнение 3d-подуровня:
+30Zn 3d104s2
У следующих элементов, от галлия до криптона, происходит заполнение 4p-подуровня по квантовым правилам. Например, электронная формула галлия:
+31Ga 3d104s24p1
Формулы остальных элементов мы приводить не будем, можете составить их самостоятельно.
Некоторые важные понятия:
Внешний энергетический уровень — это энергетический уровень в атоме с максимальным номером, на котором есть электроны.
Например, у меди (3d104s1) внешний энергетический уровень — четвёртый.
Валентные электроны — электроны в атоме, которые могут участвовать в образовании химической связи. Например, у хрома (+24Cr 3d54s1) валентными являются не только электроны внешнего энергетического уровня (4s1), но и неспаренные электроны на 3d-подуровне, т.к. они могут образовывать химические связи.
Страницы
- Главная страница
- ОСНОВЫ ОБЩЕЙ ХИМИИ
- 1.1 Важнейшие классы неорганических веществ
- 2.1 Вещества. Атомы
- 2.2 Размеры атомов
- 2.3 Молекулы. Химические формулы
- 2.4 Простые и сложные вещества
- 2.5 Валентность элементов
- 2.6 Моль. Молярная масса
- 2.7 Закон Авогадро
- 2.8 Закон сохранения массы веществ
- 2.9 Вывод химических формул
- 3.1 Строение атома. Химическая связь
- 3.2 Строение атома
- 3.4 Строение электронной оболочки атома
- 3.5 Периодическая система химических элементов
- 3.6 Зависимость свойств элементов
- 3.7 Химическая связь и строение вещества
- 3.8 Гибридизация орбиталей
- 3.9 Донорно-акцепторный механизм образования
- 3.10 Степени окисления элементов
- 4.1 Классификация химических реакций
- 4.2 Тепловые эффекты реакций
- 4.3 Скорость химических реакций
- 4.4 Необратимые и обратимые реакции
- 4.5 Общая классификация химических реакций
- НЕОРГАНИЧЕСКАЯ ХИМИЯ
- 5.1 Растворы. Электролитическая диссоциация
- 5.2 Количественная характеристика состава растворов
- 5.3 Электролитическая диссоциация
- 5.4 Диссоциация кислот, оснований и солей
- 5.5 Диссоциация воды
- 5.6 Реакции обмена в водных растворах электролитов
- 5.7 Гидролиз солей
- 6.1 Важнейшие классы неорганических веществ
- 6.2 Кислоты, их свойства и получение
- 6.3 Амфотерные гидроксиды
- 6.4 Соли, их свойства и получение
- 6.5 Генетическая связь между важнейшими классами
- 6.6 Понятие о двойных солях
- 7.1 Металлы и их соединения
- 7.2 Электролиз
- 7.3 Общая характеристика металлов
- 7.4 Металлы главных подгрупп I и II групп
- 7.5 Алюминий
- 7.6 Железо
- 7.7 Хром
- 7.8 Важнейшие соединения марганца и меди
- 8.1 Неметаллы и их неорганические соединения
- 8.2 Водород, его получение
- 8.3 Галогены. Хлор
- 8.4 Халькогены. Кислород
- 8.5 Сера и ее важнейшие соединения
- 8.6 Азот. Аммиак. Соли аммония
- 8.7 Оксиды азота. Азотная кислота
- 8.8 Фосфор и его соединения
- 8.9 Углерод и его важнейшие соединения
- 8.10 Кремний и его важнейшие соединения
- ОРГАНИЧЕСКАЯ ХИМИЯ
- 9.1 Основные положения органической химии. Углеводороды
- 9.2 Электронные эффекты заместителей в органических соединениях
- 9.3 Предельные углеводороды (алканы)
- 9.3.1 Насыщенные УВ. Метан
- 9.4 Понятие о циклоалканах
- 9.5 Непредельные углеводороды
- 9.6 Диеновые углеводороды (алкадиены)
- 9.7 Алкины
- 9.8 Ароматические углеводороды
- 9.9 Природные источники углеводородов
- 10.1 Кислородсодержащие органические соединения
- 10.2 Фенолы
- 10.3 Альдегиды
- 10.4 Карбоновые кислоты
- 10.5 Сложные эфиры. Жиры
- 10.6 Понятие о поверхностно-активных веществах
- 10.7 Углеводы
- 11.1 Амины. Аминокислоты
- 11.2 Белки
- 11.3 Понятие о гетероциклических соединениях
- 11.4 Нуклеиновые кислоты
- 12.1 Высокомолекулярные соединения
- 12.2 Синтетические волокна
Свойства соединений с ковалентной связью
Вещества с ковалентными связями делятся на две неравные группы: молекулярные и атомные (или немолекулярные), которых значительно меньше, чем молекулярных.
Молекулярные соединения в обычных условиях могут находиться в различных агрегатных состояниях: в виде газов (CO2 , NH3 , CH4 , Cl2 , O2 , NH3 ), легколетучих жидкостей (Br2 , H2O, C2H5OH ) или твердых кристаллических веществ, большинство из которых даже при очень незначительном нагревании способны быстро плавиться и легко сублимироваться (S8 , P4 , I2 , сахар С12Н22О 11 , «сухой лед» СО2 ).
Низкие температуры плавления, возгонки и кипения молекулярных веществ объясняются очень слабыми силами межмолекулярного взаимодействия в кристаллах. Именно поэтому для молекулярных кристаллов не присуща большая прочность, твердость и электрическая проводимость (лед или сахар). При этом вещества с полярными молекулами имеют более высокие температуры плавления и кипения, чем с неполярными. Некоторые из них растворимы в воде или других полярных растворителях. А вещества с неполярными молекулами, наоборот, лучше растворяются в неполярных растворителях (бензол, тетрахлорметан). Так, йод, у которого молекулы неполярные, не растворяется в полярной воде, но растворяется в неполярной CCl4 и малополярном спирте.
Немолекулярные (атомные) вещества с ковалентными связями (алмаз, графит, кремний Si, кварц SiO2 , карборунд SiC и другие) образуют чрезвычайно прочные кристаллы, за исключением графита, кристаллическая решетка которого имеет слоистую структуру. Например, кристаллическая решетка алмаза — правильный трехмерный каркас, в котором каждый sр3-гибридизованный атом углерода соединен с четырьмя соседними атомами С σ-связями. По сути весь кристалл алмаза — это одна огромная и очень прочная молекула. Аналогичное строение имеют и кристаллы кремния Si, который широко применяется в радиоэлектронике и электронной технике. Если заменить половину атомов С в алмазе атомами Si, не нарушая каркасную структуру кристалла, то получим кристалл карборунда — карбида кремния SiC — очень твердого вещества, используемого в качестве абразивного материала. А если в кристаллической решетке кремния между каждыми двумя атомами Si вставить по атому О, то образуется кристаллическая структура кварца SiO2 — тоже очень твердого вещества, разновидность которого также используют как абразивный материал.
Кристаллы алмаза, кремния, кварца и подобные им по структуре — это атомные кристаллы, они представляют собой огромные «супермолекулы», поэтому их структурные формулы можно изобразить не полностью, а только в виде отдельного фрагмента, например:
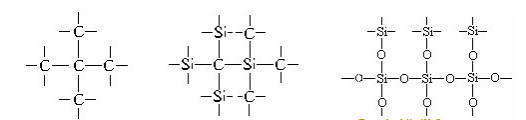
Кристаллы алмаза, кремния, кварца
Немолекулярные (атомные) кристаллы, состоящие из соединенных между собой химическими связями атомов одного или двух элементов, относятся к тугоплавким веществам. Высокие температуры плавления обусловлены необходимостью затраты большого количества энергии для разрыва прочных химических связей при плавлении атомных кристаллов, а не слабого межмолекулярного взаимодействия, как в случае молекулярных веществ. По этой же причине многие атомные кристаллов при нагревании не плавятся, а разлагаются или сразу переходят в парообразное состояние (возгонка), например, графит сублимируется при 3700oС.
Немолекулярные вещества с ковалентными связями нерастворимые в воде и других растворителях, большинство из них не проводит электрический ток (кроме графита, которому присуща электропроводность, и полупроводников — кремния, германия и др.).
Строение атома. Строение электронных оболочек атомов.
Атом — электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки. Ядро находится в центре атома и состоит из положительно заряженных протонов и незаряженных нейтронов, удерживаемых ядерными силами. Ядерное строение атома экспериментально доказал в 1911 г. английский физик Э.Резерфорд.
Число протонов определяет положительный заряд ядра и равно порядковому номеру элемента. Число нейтронов вычисляется как разность атомной массы и порядкового номера элемента. Элементы, имеющие одинаковый заряд ядра (одинаковое число протонов), но разную атомную массу (разное количество нейтронов) называются изотопами. Масса атома в основном сосредоточена в ядре, т.к. ничтожно малой массой электронов можно пренебречь. Атомная масса равна сумме масс всех протонов и всех нейтронов ядра.
Химический элемент — это вид атомов с одинаковым зарядом ядра. В настоящее время известно 118 различных химических элементов.
Все электроны атома образуют его электронную оболочку. Электронная оболочка имеет отрицательный заряд, равный общему количеству электронов. Число электронов в оболочке атома совпадает с числом протонов в ядре и равно порядковому номеру элемента. Электроны в оболочке распределены по электронным слоям согласно запасам энергии (электроны с близкими значениями энергий образуют один электронный слой): электроны с меньшей энергией находятся ближе к ядру, электроны с большей энергией находятся дальше от ядра. Число электронных слоёв (энергетических уровней) совпадает с номером периода, в котором располагается химический элемент.
Различают завершённые и незавершённые энергетические уровни. Уровень считается завершённым, если содержит максимально возможное количество электронов ( первый уровень — 2 электрона, второй уровень — 8 электронов, третий уровень — 18 электронов, четвёртый уровень — 32 электрона и т.д.). Незавершённый уровень содержит меньшее число электронов.
Уровень, максимально удалённый от ядра атома, называется внешним. Электроны, находящиеся на внешнем энергетическом уровне, называются внешними (валентными) электронами. Число электронов на внешнем энергетическом уровне совпадает с номером группы, в которой находится химический элемент. Внешний уровень считается завершённым, если содержит 8 электронов. Завершённым внешним энергетическим уровнем обладают атомы элементов 8А группы (инертные газы гелий, неон, криптон, ксенон, радон).
Область пространства вокруг ядра атома, в которой наиболее вероятно нахождение электрона, называют электронной орбиталью. Орбитали отличаются уровнем энергии и формой. По форме различают s-орбитали (сфера), p-орбитали (объёмная восьмёрка), d-орбитали и f-орбитали. На каждом энергетическом уровне есть свой набор орбиталей: на первом энергетическом уровне — одна s-орбиталь, на втором энергетическом уровне — одна s- и три p-орбитали, на третьем энергетическом уровне — одна s-, три p-, пять d-орбиталей, на четвертом энергетическом уровне одна s-, три p-, пять d-орбиталей и семь f-орбиталей. На каждой орбитале могут располагаться максимально два электрона.
Распределение электронов по орбиталям отражается с помощью электронных формул. Например, для атома магния распределение электронов по энергетическим уровням будет следующим: 2е, 8е, 2е. Данная формула показывает, что 12 электронов атома магния распределены по трём энергетическим уровням: первый уровень завершён и содержит 2 электрона, второй уровень завершён и содержит 8 электронов, третий уровень не завершён, т.к. содержит 2 электрона. Для атома кальция распределение электронов по энергетическим уровням будет следующим: 2е, 8е, 8е, 2е. Данная формула показывает, что 20 электронов кальция распределены по четырём энергетическим уровням: первый уровень завершён и содержит 2 электрона, второй уровень завершён и содержит 8 электронов, третий уровень не завершён, т.к. содержит 8 электронов, четвёртый уровень не завершён, т.к. содержит 2 электрона.
Последнее изменение: Четверг, 12 февраля 2015, 23:41
3.4. Направленность ковалентной связи
Свойства молекулы, ее способность вступать в
химическое взаимодействие с другими молекулами зависят не только от
прочности химических связей в молекуле, но в значительной мере и от ее
пространственного строения. Раздел химии, изучающий геометрическую
структуру молекул, их пространственное строение, называется
стереохимией. Выше уже говорилось, что образование ковалентной связи
является результатом перекрывания валентных электронных облаков
взаимодействующих атомов. Но такое перекрывание возможно только при
определенной взаимной ориентации электронных облаков; при этом область
перекрывания располагается в определенном направлении по отношению к
взаимодействующим атомам. Иначе говоря, ковалентная связь обладает
направленностью.
Так, в молекуле водорода перекрывание атомных s-электронных
облаков происходит вблизи прямой, соединяющей ядра взаимодействующих
атомов. Образованная подобным образом ковалентная связь называется σ-связью
(сигма-связь).
В образовании σ-связи могут принимать участие и
р-электронные облака, ориентированные вдоль оси связи. Так, в
молекуле HF (рис. 3.4, а) ковалентная σ-связь
возникает вследствие перекрывания 1s-электронного облака атома
водорода и 2p-электронного облака атома
фтора. Химическая связь в молекуле F2
(рис. 3.4, б) тоже σ-связь; она образована 2р-электронными
облаками двух атомов фтора.
При взаимодействии p-электронных
облаков, ориентированных перпендикулярно оси связи (рис. 3.5),
образуется не одна, а две области перекрывания, расположенные по обе
стороны от этой оси. Такая ковалентная связь называется
π-cвязью.
|
|
|
| а | б |
Рис.
3.4. Схемы перекрывания электронных облаков при образовании молекул: а –
HF, б – F2
Рис.
3.5. Схемы перекрывания p-электронных облаков
при образовании π-cвязи
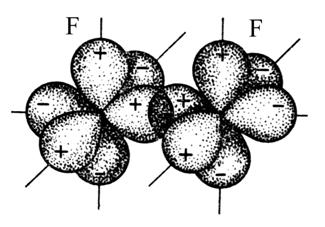
Рассмотрим образование молекулы азота
N2. Каждый атом азота обладает
тремя неспаренными 2p-электронами,
электронные облака которых ориентированы в трех взаимно перпендикулярных
направлениях.
На рис. 3.6 изображено перекрывание р-электронных
облаков в молекуле N2 (для удобства изображения перекрывание
рх-, ру— и рz-облаков
показано раздельно). Атомы азота связаны в молекуле N2
тремя ковалентными связями. Но эти связи неравноценны: одна из них σ-связь,
а две другие π-связи. Вывод о неравноценности связей в молекуле азота
подтверждается тем, что энергия их разрыва различна.
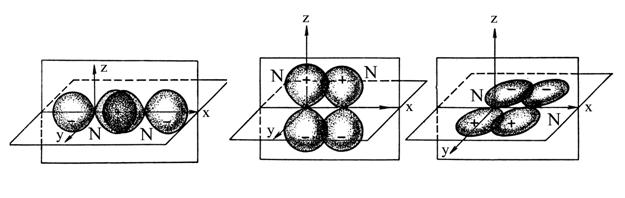
Рис.
3.6. Схемы перекрывания 2p-электронных облаков
в молекуле N2: а – σ-cвязь,
б,в — π-cвязи
Представление о направленности ковалентных связей
позволяет объяснить взаимное расположение атомов в многоатомных
молекулах. Так, при образовании молекулы воды электронные облака двух
неспаренных 2p-электронов атома
кислорода перекрываются с 1s-электронными облаками двух атомов
водорода; схема этого перекрывания изображена на рис. 3.7, а. Поскольку
р-электронные облака атома кислорода ориентированы во взаимно
перпендикулярных направлениях, то молекула Н2О имеет, как
показано на рис. 3.7, а, угловое строение, причем можно ожидать, что
угол между связями О—Н будет составлять 90°.
Молекула NH3,
образующаяся при взаимодействии трех р-электронов атома азота с
s-электронами трех атомов водорода (рис. 3.7, б), имеет структуру
пирамиды, в вершине которой находится атом азота, а в вершинах основания
— атомы водорода. И в этом случае можно ожидать, что углы между связями
N—Н будут равны 90°.
Эти выводы о взаимном расположении атомов в
молекулах NH3 и Н2О
соответствуют действительности. Однако углы между связями (валентные
углы) отличаются от 90°: в молекуле воды угол НОН составляет 104,5°, а в
молекуле аммиака угол HNH равен 107,3°
Для
объяснения отличия валентных углов в молекулах от 90° следует принять во
внимание, что устойчивому состоянию молекулы отвечают такая ее
геометрическая структура и такое пространственное расположение
электронных облаков внешних оболочек атомов, которым отвечает наименьшая
потенциальная энергия молекулы
Рис.
3.7. Схемы образования химических связей в молекулах: а – воды, б –
аммиака
Это приводит к тому, что при образовании молекулы
формы и взаимное расположение атомных электронных облаков изменяются по
сравнению с их формами и взаимным расположением в свободных атомах. В
результате достигается более полное перекрывание валентных электронных
облаков и, следовательно, образование более прочных ковалентных связей.
В рамках метода валентных связей такая перестройка электронной структуры
атома рассматривается на основе представления о гибридизации атомных
орбиталей.
3.5. Гибридизация атомных электронных орбиталей
Метод гибридизации атомных орбиталей исходит из
предположения, что при образовании молекулы вместо исходных атомных
s; p— и d-электронных
облаков образуются такие равноценные «смешанные» или гибридныеэлектронные облака, которые вытянуты по направлению к соседним
атомам, благодаря чему достигается их более полное перекрывание с
электронными облаками этих атомов. Такая деформация электронных облаков
требует затраты энергии. Но более полное перекрывание валентных
электронных облаков приводит к образованию более прочной химической
связи и, следовательно, к дополнительному выигрышу энергии. Если этот
выигрыш энергии достаточен, чтобы с избытком скомпенсировать затраты
энергии на деформацию исходных атомных электронных облаков, такая
гибридизация приводит в конечном счете к уменьшению потенциальной
энергии образующейся молекулы и, следовательно, к повышению ее
устойчивости.
Рассмотрим в качестве примера гибридизации
образование молекулы фторида бериллия BeF2.
Каждый атом фтора, входящий в состав этой молекулы, обладает одним
неспаренным электроном, который и участвует в образовании ковалентной
связи:
Атом
бериллия в невозбужденном состоянии (1s22s2)
неспаренных электронов не имеет. Поэтому для участия в образовании
химических связей атом бериллия должен перейти в возбужденное состояние
(1s2 2s12p1):
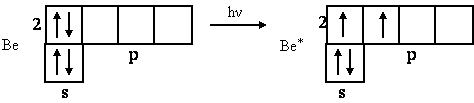
Образовавшийся возбужденный атом
Be* обладает двумя неспаренными электронами:
электронное облако одного из них соответствует состоянию 2s,
другого — 2р. При перекрывании этих электронных облаков с р-электронными
облаками двух атомов фтора могут образоваться ковалентные связи (рис.
3.8). Однако, как уже было сказано, при затрате некоторой энергии вместо
исходных s- и р-орбиталей атома бериллия могут
образоваться две равноценные гибридные орбитали (sp-орбитали).
Форма и расположение этих орбиталей показаны на рис. 3.9, из которого
видно, что гибридные sp-орбитали вытянуты в противоположных
направлениях.
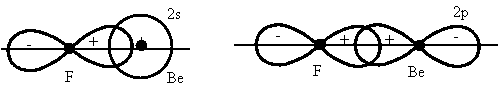
Рис.
3.8. Схема перекрывания 2p-электронных облаков
фтора с 2s- и 2p-электронными
облаками атома бериллия
Рис.
3.9. Форма и взаимное расположение гибридных sp-электронных
облаков атома бериллия
Перекрывание гибридных sp-электронных
облаков атома бериллия с р-электронными облаками атомов фтора изображено
на рис. 3.10. Благодаря вытянутой форме гибридных орбиталей, достигается
более полное перекрывание взаимодействующих электронных облаков, а
значит, образуются более прочные химические связи.
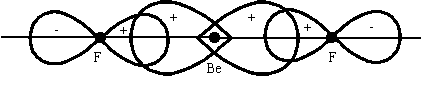
Рис.
3.10. Схема образования химических связей в молекуле
BeF2
Рассмотренный случай гибридизации одной s—
и одной р-орбитали, приводящий к образованию двух
sp-орбиталей, называется sp-гибридизацией.
Как показывает рис. 3.9, sp-орбитали ориентированы в
противоположных направлениях, что приводит к линейному строению
молекулы.
![]()
![]()
Возможны и другие случаи гибридизации атомных
орбиталей, однако число образующихся гибридных орбиталей всегда равно
общему числу исходных атомных орбиталей, участвующих в гибридизации.
Так, при гибридизации одной s— и двух р-орбиталей
образуются три равноценные sp2-орбитали.
В этом случае гибридные электронные облака располагаются в направлениях,
лежащих в одной плоскости и ориентированных под углами 120° друг к другу
(рис. 3.11). Очевидно, что этому типу гибридизации соответствует
образование плоской треугольной молекулы.
Рис.
3.11. Взаимное расположение гибридных sp2-электронных
облаков
![]()
Примером молекулы, в которой осуществляется
sp2-гибридизация, может служить
молекула фторида бора ВF3.
Если в гибридизации участвуют одна s— и три
р-орбитали (sp3-гибридизация),
то в результате образуются четыре гибридные sрЗ-орбитали,
вытянутые в направлениях к вершинам тетраэдра, т. е. ориентированные под
углами 109°28′ друг к другу (рис. 3.12).
Рис.
3.12. Взаимное расположение гибридных sp3-электронных
облаков
Такая гибридизация
осуществляется, например, в возбужденном атоме углерода при образовании
молекулы метана СН4. Поэтому молекула метана имеет форму
тетраэдра, причем все четыре связи С—Н в этой молекуле равноценны:
Вернемся к рассмотрению структуры молекулы воды.
При её образовании происходит sp3-гибридизация
атомных орбиталей кислорода. Именно поэтому валентный угол НОН в
молекуле воды (104,5°) близок не к 90°, а к тетраэдрическому углу
(109,5°).
![]()
При образовании молекулы аммиака также происходит
sp3-гибридизация атомных
орбиталей центрального атома (азота). Именно поэтому валентный угол
HNH (107,3°) близок к тетраэдрическому.
![]()
Влияние валентности элементов в химических реакциях.
Даже того как ученые узнали, что атом — это не мельчайшая частица в мире, они уже оперировали этим понятием. Они понимали, что есть внутренний фактор, который влияет на протекание химической реакции различных веществ. Из-за того, что ученые по-разному видели строение молекулы, понятие «валентность элемента» пережило несколько метаморфоз.
Валентность вещества определяется количеством внешних электронов атома. Каким количеством электронов атом обладает, столько максимально соединений он способен совершить. Таким образом «валентность» подразумевает собою число электронных пар атомов.
Хотя электронная теория появилась намного позже, после «разделения» атома на более мелкие частицы, до этого ученые все равно вполне успешно определяли валентность в большинстве случаев. Удавалось им это благодаря химическому анализу веществ.
Это была тяжелая работа: прежде всего, требовалось определить массу элемента в чистом виде. Далее, с помощью химического анализа, ученые определяли каков состав соединения, и только потом могли высчитать, сколько атомов содержит в себе молекула вещества.
Этот метод все еще используется, но не является универсальным. Так удобно определять элемент в простом соединении веществ. Например, с одновалентным водородом, или двухвалентным кислородом.
Но уже при работе с кислотами метод не особо удачный. Нет, мы можем частично использовать его, например, при определении валентности соединений кислотных остатков.
Выглядит это так: используя знание, что валентность кислорода всегда равна двум, мы можем с легкостью высчитать валентность всего кислотного остатка. Например, в H2SO3 валентность SO3 – I, в HСlO3 валентность СlO3 – I.
Таблица валентности химических элементов.
| Порядковый номер химического элемента, он же: атомный номер, он же: зарядовое число атомного ядра, он же: атомное число | Русское / Английское наименование | Химический символ | Валентность |
| 1 | Водород / Hydrogen | H | (-1), +1 |
| 2 | Гелий / Helium | He | |
| 3 | Литий / Lithium | Li | +1 |
| 4 | Бериллий / Beryllium | Be | +2 |
| 5 | Бор / Boron | B | -3, +3 |
| 6 | Углерод / Carbon | C | (+2), +4 |
| 7 | Азот / Nitrogen | N | -3, -2, -1, (+1), +2, +3, +4, +5 |
| 8 | Кислород / Oxygen | O | -2 |
| 9 | Фтор / Fluorine | F | -1, (+1) |
| 10 | Неон / Neon | Ne | |
| 11 | Натрий / Sodium | Na | +1 |
| 12 | Магний / Magnesium | Mg | +2 |
| 13 | Алюминий / Aluminum | Al | +3 |
| 14 | Кремний / Silicon | Si | -4, (+2), +4 |
| 15 | Фосфор / Phosphorus | P | -3, +1, +3, +5 |
| 16 | Сера / Sulfur | S | -2, +2, +4, +6 |
| 17 | Хлор / Chlorine | Cl | -1, +1, (+2), +3, (+4), +5, +7 |
| 18 | Аргон / Argon | Ar | |
| 19 | Калий / Potassium | K | +1 |
| 20 | Кальций / Calcium | Ca | +2 |
| 21 | Скандий / Scandium | Sc | +3 |
| 22 | Титан / Titanium | Ti | +2, +3, +4 |
| 23 | Ванадий / Vanadium | V | +2, +3, +4, +5 |
| 24 | Хром / Chromium | Cr | +2, +3, +6 |
| 25 | Марганец / Manganese | Mn | +2, (+3), +4, (+6), +7 |
| 26 | Железо / Iron | Fe | +2, +3, (+4), (+6) |
| 27 | Кобальт / Cobalt | Co | +2, +3, (+4) |
| 28 | Никель / Nickel | Ni | (+1), +2, (+3), (+4) |
| 29 | Медь / Copper | Сu | +1, +2, (+3) |
| 30 | Цинк / Zinc | Zn | +2 |
| 31 | Галлий / Gallium | Ga | (+2). +3 |
| 32 | Германий / Germanium | Ge | -4, +2, +4 |
| 33 | Мышьяк / Arsenic | As | -3, (+2), +3, +5 |
| 34 | Селен / Selenium | Se | -2, (+2), +4, +6 |
| 35 | Бром / Bromine | Br | -1, +1, (+3), (+4), +5 |
| 36 | Криптон / Krypton | Kr | |
| 37 | Рубидий / Rubidium | Rb | +1 |
| 38 | Стронций / Strontium | Sr | +2 |
| 39 | Иттрий / Yttrium | Y | +3 |
| 40 | Цирконий / Zirconium | Zr | (+2), (+3), +4 |
| 41 | Ниобий / Niobium | Nb | (+2), +3, (+4), +5 |
| 42 | Молибден / Molybdenum | Mo | (+2), +3, (+4), (+5), +6 |
| 43 | Технеций / Technetium | Tc | +6 |
| 44 | Рутений / Ruthenium | Ru | (+2), +3, +4, (+6), (+7), +8 |
| 45 | Родий / Rhodium | Rh | (+2), (+3), +4, (+6) |
| 46 | Палладий / Palladium | Pd | +2, +4, (+6) |
| 47 | Серебро / Silver | Ag | +1, (+2), (+3) |
| 48 | Кадмий / Cadmium | Cd | (+1), +2 |
| 49 | Индий / Indium | In | (+1), (+2), +3 |
| 50 | Олово / Tin | Sn | +2, +4 |
| 51 | Сурьма / Antimony | Sb | -3, +3, (+4), +5 |
| 52 | Теллур / Tellurium | Te | -2, (+2), +4, +6 |
| 53 | Иод / Iodine | I | -1, +1, (+3), (+4), +5, +7 |
| 54 | Ксенон / Xenon | Xe | |
| 55 | Цезий / Cesium | Cs | +1 |
| 56 | Барий / Barium | Ba | +2 |
| 57 | Лантан / Lanthanum | La | +3 |
| 58 | Церий / Cerium | Ce | +3, +4 |
| 59 | Празеодим / Praseodymium | Pr | +3 |
| 60 | Неодим / Neodymium | Nd | +3, +4 |
| 61 | Прометий / Promethium | Pm | +3 |
| 62 | Самарий / Samarium | Sm | (+2), +3 |
| 63 | Европий / Europium | Eu | (+2), +3 |
| 64 | Гадолиний / Gadolinium | Gd | +3 |
| 65 | Тербий / Terbium | Tb | +3, +4 |
| 66 | Диспрозий / Dysprosium | Dy | +3 |
| 67 | Гольмий / Holmium | Ho | +3 |
| 68 | Эрбий / Erbium | Er | +3 |
| 69 | Тулий / Thulium | Tm | (+2), +3 |
| 70 | Иттербий / Ytterbium | Yb | (+2), +3 |
| 71 | Лютеций / Lutetium | Lu | +3 |
| 72 | Гафний / Hafnium | Hf | +4 |
| 73 | Тантал / Tantalum | Ta | (+3), (+4), +5 |
| 74 | Вольфрам / Tungsten | W | (+2), (+3), (+4), (+5), +6 |
| 75 | Рений / Rhenium | Re | (-1), (+1), +2, (+3), +4, (+5), +6, +7 |
| 76 | Осмий / Osmium | Os | (+2), +3, +4, +6, +8 |
| 77 | Иридий / Iridium | Ir | (+1), (+2), +3, +4, +6 |
| 78 | Платина / Platinum | Pt | (+1), +2, (+3), +4, +6 |
| 79 | Золото / Gold | Au | +1, (+2), +3 |
| 80 | Ртуть / Mercury | Hg | +1, +2 |
| 81 | Талий / Thallium | Tl | +1, (+2), +3 |
| 82 | Свинец / Lead | Pb | +2, +4 |
| 83 | Висмут / Bismuth | Bi | (-3), (+2), +3, (+4), (+5) |
| 84 | Полоний / Polonium | Po | (-2), +2, +4, (+6) |
| 85 | Астат / Astatine | At | нет данных |
| 86 | Радон / Radon | Rn | |
| 87 | Франций / Francium | Fr | нет данных |
| 88 | Радий / Radium | Ra | +2 |
| 89 | Актиний / Actinium | Ac | +3 |
| 90 | Торий / Thorium | Th | +4 |
| 91 | Проактиний / Protactinium | Pa | +5 |
| 92 | Уран / Uranium | U | (+2), +3, +4, (+5), +6 |
Чего не указано в таблице валентности, это то, что валентность элемента может быть постоянной и переменной.
| Виды валентности | |
| Постоянная (у металлов главных подгрупп) | Переменная (у неметаллов и металлов побочных подгрупп) |
| Высшая (равна номеру группы) | Низшая (равна разности между числом 8 и номером группы) |
Знание валентности элементов необходимы для правильного составления химических формул соединений.
Ваша оценка?
Мне нравитсяНе нравится
Таблица электронных формул атомов химических элементов (4 часть):
| 91 | Протактиний | Pa | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f2 6s2 6p6 6d1 7s2 |
| 92 | Уран | U | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f3 6s2 6p6 6d1 7s2 |
| 93 | Нептуний | Np | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f4 6s2 6p6 6d1 7s2 |
| 94 | Плутоний | Pu | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f6 6s2 6p6 7s2 |
| 95 | Америций | Am | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f7 6s2 6p6 7s2 |
| 96 | Кюрий | Cm | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f7 6s2 6p6 6d1 7s2 |
| 97 | Берклий | Bk | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f9 6s2 6p6 7s2 |
| 98 | Калифорний | Cf | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f10 6s2 6p6 7s2 |
| 99 | Эйнштейний | Es | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f11 6s2 6p6 7s2 |
| 100 | Фермий | Fm | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f12 6s2 6p6 7s2 |
| 101 | Менделевий | Md | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f13 6s2 6p6 7s2 |
| 102 | Нобелий | No | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f14 6s2 6p6 7s2 |
| 103 | Лоуренсий | Lr | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f14 6s2 6p6 6d1 7s2 |
| 104 | Резерфордий (Курчатовий) | Rf | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f14 6s2 6p6 6d2 7s2 |
| 105 | Дубний (Нильсборий) | Db | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f14 6s2 6p6 6d3 7s2 |
| 106 | Сиборгий | Sg | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f14 6s2 6p6 6d4 7s2 |
| 107 | Борий | Bh | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f14 6s2 6p6 6d5 7s2 |
| 108 | Хассий | Hs | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f14 6s2 6p6 6d6 7s2 |
| 109 | Мейтнерий | Mt | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f14 6s2 6p6 6d7 7s2 |
| 110 | Дармштадтий | Ds | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f14 6s2 6p6 6d8 7s2
либо 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f14 6s2 6p6 6d9 7s1 |
Коэффициент востребованности
2 040