Строение
Кальций – 20 элемент периодической таблицы. Находится во второй группе, четвёртом периоде. Относится к элементам s-семейства. Электронное строение атома кальция – 1s22s22p63s23p64s2 или +20 Ca)2)8)8)2.
Рис. 1. Кальций в таблице Менделеева.
Ядро атома содержит 20 протонов и 20 нейронов, имеет положительный заряд +20. Вокруг ядра по четырём орбитам движется 20 электронов. Последний энергетический s-уровень содержит два спаренных электрона, поэтому постоянная валентность кальция – II.
В соединениях атом кальция отдаёт два электрона, выполняя функцию восстановителя. Степень окисления кальция – +2.
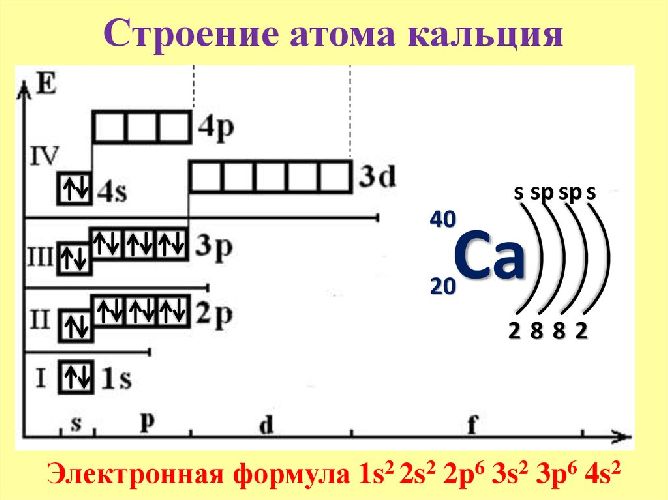 Рис. 2. Строение атома.
Рис. 2. Строение атома.
Кальций не может переходить в возбуждённое состояние.
Презентация на тему: » Составления электронных и электронно-графических схем строения атома.» — Транскрипт:
1
Составления электронных и электронно-графических схем строения атома
2
Терминологический диктант Электрон Атомная орбиталь Электронная оболочка Энергетический уровень Энергетический подуровень
3
Чтобы правильно изображать электронные конфигурации атомов, нужно ответить на вопросы: 1. Как определить общее число электронов в атоме? 2. Каково максимальное число электронов на уровнях, подуровнях? 3. Какой порядок заполнения подуровней и орбиталей? 3
4
Электронные конфигурации (на примере атома водорода) 1. Схема электронного строения Схема электронного строения атомов показывают распределение электронов по энергетическим уровням 2. Электронная формула 1s 1, где s-обозначение подуровня; 1 — число электронов Электронные формулы атомов показывают распределение электронов по энергетическим подуровням 3. Электронно-графическая формула Электронно-графичесие формулы атомов показывают распределение электронов по орбиталям и спины электронов 4
5
1. Запиши знак химического элемента алюминия. Перед ним внизу укажи его порядковый номер. 5 Al 13
6
2. По образцу составь электронную формулу алюминия Порядок заполнения энергетических уровней в атоме. 1s 2, 2s 2, 2p 6, 3s 2, 3p 1 6 У алюминия 13 электронов Первым в атоме заполняется 1s подуровень На нем максимально может быть 2 электрона, отметим их и вычтем из общего числа электронов. Осталось разместить 11 электронов. Заполняется следующий 2s подуровень, на нем может быть 2 электрона. Осталось разместить 9 электронов. Заполняется следующий 2p подуровень, на нем может быть 6 электронов. Далее заполняем 3s подуровень Дошли до 3p подуровня, на нем максимально может быть 6 электронов, но осталось только 1, его и помещаем. 1s = Al s2s2s 2p2p 3p — 2 = — 6 = — 2 = 9 3 1
7
3. Определи: По порядку ли идут энергетические уровни. Если уровни идут по порядку, то так их и оставь. Если уровни идут не по порядку, то перепиши их, расставив по возрастанию. Нет. 4s и 3d подуровни идут не по порядку. Надо переписать и расставить их по мере возрастания. 7 Cr 24 1s 2 2p62p6 3s 2 4s 2 3p 6 3d 4 2s22s2 1s 2 2p62p6 3s 2 4s 2 3p 6 3d 4 2s22s2
8
Правила для составления электронно-графической схемы Каждый подуровень имеет определенное число орбиталей На каждой орбитали могут находиться не более двух электронов Если на орбитале два электрона, то у них должен быть разный спин (стрелки смотрят в разные стороны). 8 s p d f Приступаем к составлению электронно-графической схемы
9
4. Составь электронно-графическую схемы для хлора 9 Cl 17 1s 2 2p62p6 3s 2 2s22s2 1s 2 2p62p6 3s 2 3p 5 2s22s2 1s 2 2p62p6 3s 2 3p 5 2s22s2
10
5. Географическое путешествие Определите, в каких группах периодической системы находятся химические элементы, электронные формулы атомов которых приведены в первом столбце таблицы. Буквы, соответствующие правильным ответам, дадут название стране. 10 ЯМАЙКА Электронные формулы Группы IIIIIIIVVVIVII 1s 2 2s 1 ЯГЛРКАО 1s 2 2s 2 2p 6 3s 2 3p 5 ВИСНПДМ 1s 2 2s 2 2p 6 3s 2 3p 4 ЕФТЗЯАО 1s 2 2s 2 2p 4 ГРИСЬЙК 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 КУЕРМИП 1s 2 2s 2 2p 6 3s 1 АНДЛОЖЛ
Свойства атома кальция:
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 40,078(4) а.е.м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 4s2 |
| 203 | Электронная оболочка |
K2 L8 M8 N2 O0 P0 Q0 R0 |
| 204 | Радиус атома (вычисленный) | 194 пм |
| 205 | Эмпирический радиус атома* | 180 пм |
| 206 | Ковалентный радиус* | 176 пм |
| 207 | Радиус иона (кристаллический) | Ca2+
114 (6) пм, 126 (8) пм, 137 (10) пм, 148 (12) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 231 пм |
| 209 | Электроны, Протоны, Нейтроны | 20 электронов, 20 протонов, 20 нейтронов |
| 210 | Семейство (блок) | элемент s-семейства |
| 211 | Период в периодической таблице | 4 |
| 212 | Группа в периодической таблице | 2-ая группа (по старой классификации – главная подгруппа 2-ой группы) |
| 213 | Эмиссионный спектр излучения |  |
Что такое атом?
Итак, внутри нашей молекулярной матрешки обнаружилась матрешка атомная. Возможно, вы не до конца уловили, как мистеру Далтону удалось без микроскопов, практически с завязанными глазами, показать, что молекулы ряда веществ имеют деление на элементы еще более маленького порядка. Это нормально: подноготная подобных экспериментальных заключений станет яснее далее при изучении курса химии. Как и полная история открытия современного понятия атома. Вы обязательно познакомитесь с атомом снова — полнее и фундаментальнее.
Сейчас нам достаточно разобрать матрешку до куколки, где «рождаются» электрические процессы.
Поэтому чтобы не запутать и без того запутанную тему, опустим детали, как Томпсон открывает электрон экспериментами с вакуумной трубкой, как к делу подключаются Резерфорд, Бор, Планк, Содди, Гейзенберг, внося лепту в понимание подлинного строения вещества — это все впереди. Просто чтобы вы осознавали: ученые на протяжении десятилетий взаимодополняли опыты друг друга, постепенно открывая все новые и новые положения. Атом — коллективная находка, и к ней шли очень долго.
Так что остановимся исключительно на результатах.
Положение водорода в периодической системе
Если посмотреть на периодическую таблицу, то можно заметить, что у водорода двойственное положение. Водород – элемент, порядковый номер которого 1. Его электронная формула: 1s1. Водород – элемент, у которого на единственной орбитали располагается только один электрон.
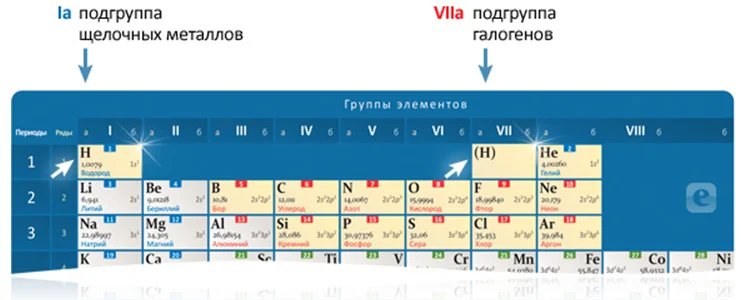
Водород – двойной агент, который может быть как окислителем, так и восстановителем. Он может входить как в I, так и в VII группу. Это связано с тем, что он имеет черты сходства и со щелочными металлами, и с галогенами.
Если водород выступает в роли восстановителя, то он стоит в первой группе. В этом случае ему характерна степень окисления +1. Например, водород-восстановитель в соединениях Н2О, HCl.Если водород выступает в роли окислителя, то он стоит в седьмой группе.В этом случае для элемента характерна степень окисления -1. Например, водород-окислитель в соединениях NaH, CaH2.
Двойственность водорода связана с тем, что у него только один электрон. На s-уровне может находиться только два электрона. Поэтому водород с легкостью отдает свой единственный электрон или отнимает электрон у другого элемента.
Положение элемента кальция в периодической системе, физические, химические свойства
Билет № 19
Положение в периодической системе: кальций находится в 4 периоде, II группе, главной (А) подгруппе.
Атомный номер кальция 20, следовательно, заряд атома равен +20, число электронов 20. Четыре электронных уровня, на внешнем уровне 2 электрона.
Схема расположения электронов по уровням:
20Ca ) ) ) )
2 8 8 2
Ядро атома кальция 40Ca содержит 20 протонов (равно заряду ядра) и 20 нейтронов (атомная масса минус число протонов: 40 − 20 = 20).
Кальций относится к щелочноземельным металлам, отличающимся химической активностью. Кальций хранят под слоем керосина, т. к. на воздухе он быстро покрывается слоем оксида. При нагревании горит:
- 2Ca + O2 = 2CaO
- Кальций вытесняет из воды водород. Если поместить кусочек кальция в воду, он тонет, но вскоре всплывает из-за образовавшихся на
нём пузырьков водорода: - Ca + 2HOH = Ca(OH)2↓ + H2↑
- (раствор мутнеет из-за выпадающего осадка гидроксида кальция)
- Кальций реагирует с кислотами, например, с соляной кислотой с образованием хлорида кальция:
- Ca + 2HCl = CaCl2 + H2↑
Кальций широко распространен в земной коре. Карбонаты кальция (мел, гипс, известняк), сульфат кальция (гипс, алебастр), гидроксид кальция (гашеная известь) широко применяются в строительстве. Фосфаты кальция (фосфориты) используются в качестве фосфорных удобрений.
Карбонат и фосфат кальция входят в состав костей человека, придавая им твердость.
2. Задача. Вычисление количества вещества продукта реакции, если известна масса одного из исходных веществ.
Пример:
Сколько моль хлорида цинка можно получить, имея 365 г соляной кислоты?
Решение:
- Записываем уравнение реакции.
- Записываем над уравнением реакции имеющиеся данные, а под уравнением — массу и число моль согласно уравнению (равно коэффициенту перед веществом):
10 моль x моль
Zn + 2HCl = ZnCl2 + H2↑
2 моль 1 моль
Количество вещества соляной кислоты по условию задачи находим так:
M (HCl) = 1 + 35,5 = 36,5 (г/моль)n = m / M = 365 г : 36,5 г/моль = 10 моль
- Составляем пропорцию:
10 моль — х моль2 моль — 1 моль
- Находим x:
x = 10 моль • 1 моль / 2 моль = 5 моль
Ответ: 5 моль.
Главные правила образования оболочки электронов в атоме
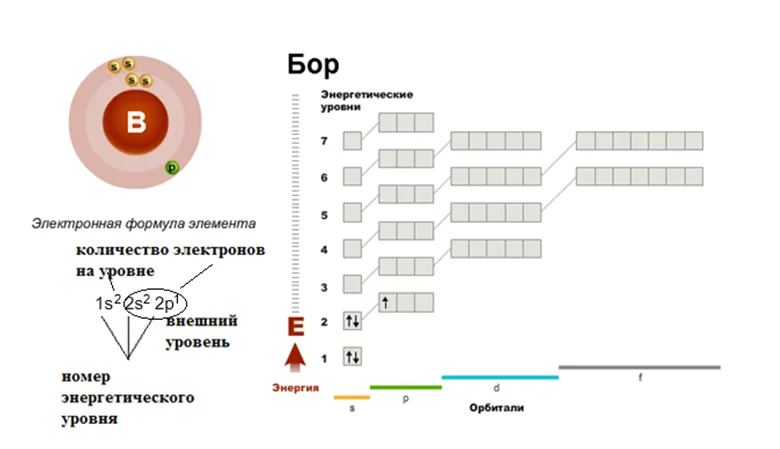
Давайте дадим волю фантазии, допустим, к нашему семиэтажному дому подошёл Бор, не лес как вы могли подумать, а элемент. Смотрим в шпаргалку, как вы уже догадались, это будет периодическая таблица, и ищем там его расположение. Бор занимает ячейку под номером 5. Эта ячейка находится во втором периоде, третьей группе. Значит, число электронов в атоме 5, они размещаются на I и II этажах. Первый уровень будут занимать 2 электрона. Значит на второй этаж (внешний уровень) переходят оставшиеся 3. Два будут занимать s-подуровень, один будет размещаться на р-подуровне. Строение оболочки атома В (бор).
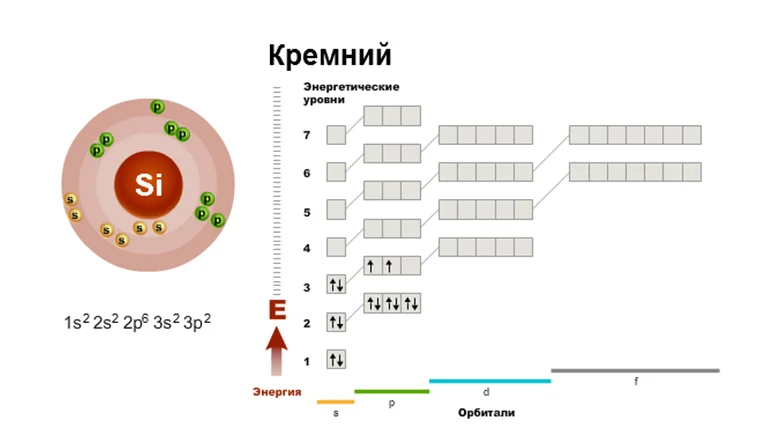
Составим электронную и графическую схему элемента на примере Si и V с помощью алгоритма.

Обратите внимание, чтобы составить электронную формулу элемента, достаточно знать его расположение в ПСХЭ. Итак, начинаем по порядку
- Кремний, находится под № 14, символ Si.Ar (Si) = 28
- Заряд ядра +14. e = 14, р = 14, n = 28 – 14 = 14
- III период, IV (А)группа.
- Энергетических уровней 3. Не забываем, что следуя правилу Гунда, электроны занимают, ячейку по одному на внешнем p-подуровне
- Исходя с этого всего, электронная оболочка атома записывается в виде формулы
- Ванадий, № 23, символ V.
- Заряд ядра +23. Электронов 23.
- IV период, V(Б) группе.
- Энергетических уровней 4. IV открывает большие периоды, которые имеют свою особенность заполнения. Применив принцип Клечковского, мы увидим, что изначально заполняется 4s-подуровень, а только тогда 3d-подуровень.
- Исходя с этого всего, схема строения электронной оболочки атома запишется в следующем виде.
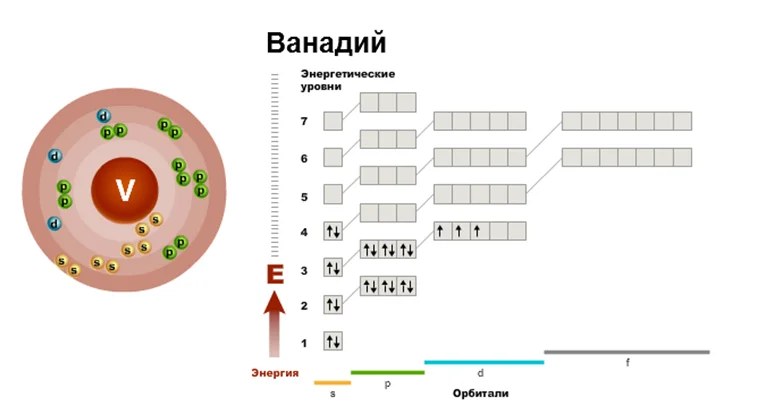
Существует основное состояние электрона в атоме и возбуждённое, которое возникает, если к атому применить некоторую определённую энергию. Электроны во внешнем электронном слое атома имеют способность перемещаться, занимая место на свободной орбитали, образуя при этом возбуждённое состояние.
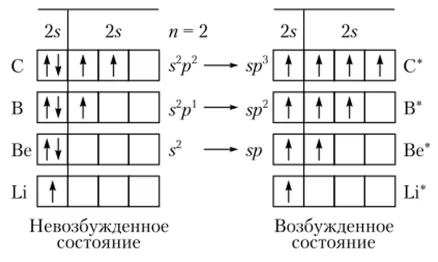
Обратите внимание, число неспаренных электронов отвечает валентности элементов: Li (I), Be (II), B (III), C (II и IV)
Проскок электрона
| Как умеет скакать электрон?Иногда при заполнении энергетических подуровней мы нарушаем порядок заполнения подуровней. В первую очередь, это связано с заполнением s- и d-подуровней . Электрон перемещается с внешнего s- на предвнешний d-подуровень. Так образуется более устойчивая заполненная или полузаполненная конфигурация.Такое явление называется проскоком электрона: электрон как бы нарушает общую очередь элементов в оболочке и обходит их. |
Это явление характерно для элементов IB и VIB групп, например, Cr, Cu, Ag.
Например, у меди электронная оболочка должна выглядеть как ..3d94s2. Но так как для заполнения d-подуровня не хватает одного электрона, то более выгодной становится ситуация, когда с s-подуровня электрон “перепрыгивает” на внутренний d-подуровень. В результате, конфигурация меди выглядит как 3d104s11

| Итог: иметь конфигурации nd5 и nd10 более энергетически выгодно, чем nd4 и nd9. Поэтому у таких элементов, как Cu, Cr, Ag, Au, Nb, Mo, Ru, Pt, Pd происходит проскок (провал) электрона: электрон с верхнего “этажа” как будто проваливается на нижний. |
Классификация химических элементов: s-,p-,d-,f-элементы
В зависимости от положения “последнего электрона” бывают s-, p-, d-, f-элементы:
- s-элементы: IA и IIA группы;
- p-элементы: IIIA-VIIIA группы;
- d-элементы: элементы побочных подгрупп;
- f-элементы: вынесены в отдельную группу лантаноидов и актиноидов.
У s- и p-элементов валентные электроны находятся на внешнем уровне.
У d-элементов — на внешнем s- и на предвнешнем d-подуровнях.

Далее приведены электронные формулы атомов элементов первых четырех периодов. Благодаря этой шпаргалке всегда можно сверить свой вариант электронной конфигурации и проверить себя.

Продолжение темы читайте в статье «Строение атома и электронные конфигурации 2.0».
Кальций: строение атома, распространение в природе. Физические и химические свойства кальция. Добыча и применение кальция
Кальций: строение атома, распространение в природе. Физические и химические свойства кальция. Добыча и применение кальция
Кальций — металлический элемент главной подгруппы II группы 4 периода периодической системы химических элементов. Он относится к семейству щелочноземельных металлов.
На внешнем энергетическом уровне атома Кальция содержится 2 спаренных s-электрона, которые он способен энергично отдавать при химических взаимодействиях.
Таким образом, Кальций является восстановителем и в своих соединениях имеет степень окисления +2.
В природе Кальций встречается только в виде солей. Массовая доля Кальция в земной коре — 3,6 %. Основным природным минералом Кальция кальцит CaCO3 и его разновидности — известняк, мел, мрамор.
Существуют и живые организмы (например, кораллы), костяк которых состоит преимущественно из кальций карбоната.
Также важными минералами Кальция доломит CaCO3 · MgCO3, флюорит CaF2, гипс CaSO4 · 2H2O, апатит, полевой шпат и др.
Кальций играет важную роль в жизнедеятельности живых организмов. Массовая доля Кальция в человеческом организме составляет 1,4-2 %.
Чтобы обеспечить организм достаточным количеством Кальция, следует обязательно потреблять молоко и молочные продукты, зеленые овощи, рыбу.
Простое вещество кальций — это типичный металл серебристо-белого цвета. Он довольно твердый, пластичный, имеет плотность 1,54 г/см3 и температуру плавления 842 ºС.
Химически кальций очень активный. При обычных условиях он легко взаимодействует с кислородом и влагой воздуха, поэтому его хранят в герметически закрытых сосудах. При нагревании на воздухе кальций загорается и образует оксид:
- 2Ca + O2 = 2CaO.
- С хлором и бромом кальций реагирует при нагревании, а с фтором — даже на холоде. Продуктами этих реакций являются соответствующие галогениды, например:
- Са + Сl2 = CaСl2.
- При нагревании кальция с серой образуется кальций сульфид:
- Ca + S = CaS.
- Кальций может реагировать и с другими неметаллами.
- Взаимодействие с водой приводит к образованию малорозчинного кальций гидроксида и выделения газуватого водорода:
- Ca + 2H2O = Ca(OH)2
+ H2.
Металлический кальций широко используется. Его используют как розкисник при изготовлении сталей и сплавов, как восстановитель для добывания некоторых тугоплавких металлов.
Кальций получают электролизом расплава кальций хлорида. Таким способом кальций был впервые получен в 1808 году Гемфри Дэви.
Атом и молекула кальция. Формула кальция. Строение кальция:
Кальций (лат. Calcium, от лат. calx (в родительном падеже calcis) – «известь», «мягкий камень») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Ca и атомным номером 20. Расположен в 2-й группе (по старой классификации – главной подгруппе второй группы), четвертом периоде периодической системы.
Кальций – щёлочноземельный металл.
Как простое вещество кальций при нормальных условиях представляет собой умеренно твёрдый, серебристо-белый металл.
Молекула кальция одноатомна.
Химическая формула кальция Ca.
Электронная конфигурация атома кальция 1s2 2s2 2p6 3s2 3p6 4s2. Потенциал ионизации (первый электрон) атома кальция равен 589,83 кДж/моль (6,1131554(3) эВ).
Строение атома кальция. Атом кальция состоит из положительно заряженного ядра (+19), вокруг которого по четырем оболочкам движутся 20 электронов. При этом 18 электронов находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку кальций расположен в четвертом периоде, оболочек всего четыре. Первая – внутренняя оболочка представлена s-орбиталью. Вторая и третья – внутренние оболочки представлена s- и р-орбиталями. Четвертая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома кальция – на 4s-орбитали находится два спаренных электрона. В свою очередь ядро атома кальция состоит из 20 протонов и 20 нейтронов. Кальций относится к элементам s-семейства.
Радиус атома кальция (вычисленный) составляет 194 пм.
Атомная масса атома кальция составляет 40,078(4) а. е. м.
Кальций – седьмой по распространённости элемент в земной коре. Содержание его в земной коре составляет 1,5 %, в океанах и морях – 0,042 %.
Кальций очень легко вступает в химические реакции.
Способы получения
В свободном виде выделить металл долгое время не удавалось, так как его химическая активность высока, в природе в чистом виде не встретишь. Поэтому вплоть до XIX века (1808 года) рассматриваемый элемент был еще одной загадкой, которую несла таблица Менделеева.
Кальций как металл сумел синтезировать английский химик Гемфри Дэви. Именно он первым обнаружил особенности взаимодействия расплавов твердых минералов и солей с электрическим током. На сегодняшний день до сих пор самым актуальным способом получения данного металла является электролиз его солей, таких как:
- смесь хлоридов кальция и калия;
- смесь фторида и хлорида кальция.
Также можно извлечь кальций из его оксида при помощи распространенного в металлургии метода алюминотермии.
Эксперимент Юнга
В ходе эксперимента на экран с двумя прорезанными в нем щелями был направлен поток электронов. Проходя через эти прорези, электроны сталкивались с поверхностью еще одного – проекционного – экрана, оставляя на нем свой след. В результате такой «бомбардировки» на проекционном экране появлялась интерференционная картина, подобная той, которая появилась бы, если бы через две прорези проходили бы волны, но не частицы.
Такой рисунок возникает из-за того, что волна, проходя между двух щелей, делится на две волны. В результате дальнейшего движения волны накладываются друг на друга, и на некоторых участках происходит их взаимное гашение. В результате мы получаем много полос на проекционном экране, вместо одной, как это было бы, если бы электрон вел себя как частица.
Интерференционная картина
Электронные формулы элементов первых четырех периодов
Рассмотрим заполнение электронами оболочки элементов первых четырех периодов. У водорода заполняется самый первый энергетический уровень, s-подуровень, на нем расположен 1 электрон:
+1H 1s1 1s
У гелия 1s-орбиталь полностью заполнена:
+2He 1s2 1s
Поскольку первый энергетический уровень вмещает максимально 2 электрона, у лития начинается заполнение второго энергетического уровня, начиная с орбитали с минимальной энергией — 2s. При этом сначала заполняется первый энергетический уровень:
+3Li 1s22s1 1s 2s
У бериллия 2s-подуровень заполнен:
+4Be 1s22s2 1s 2s
Далее, у бора заполняется p-подуровень второго уровня:
+5B 1s22s22p1 1s 2s 2p
У следующего элемента, углерода, очередной электрон, согласно правилу Хунда, заполняет вакантную орбиталь, а не заполняет частично занятую:
+6C 1s22s22p2 1s 2s 2p
Попробуйте составить электронную и электронно-графическую формулы для следующих элементов, а затем можете проверить себя по ответам конце статьи:
5. Азот
6. Кислород
7. Фтор
У неона завершено заполнение второго энергетического уровня:
+10Ne 1s22s22p6 1s 2s 2p
У натрия начинается заполнение третьего энергетического уровня:
+11Na 1s22s22p63s1 1s 2s 2p 3s
От натрия до аргона заполнение 3-го уровня происходит в том же порядке, что и заполнение 2-го энергетического уровня. Предлагаю составить электронные формулы элементов от магния до аргона самостоятельно, проверить по ответам.
8. Магний
9. Алюминий
10. Кремний
11. Фосфор
12. Сера
13. Хлор
14. Аргон
А вот начиная с 19-го элемента, калия, иногда начинается путаница — заполняется не 3d-орбиталь, а 4s. Ранее мы упоминали в этой статье, что заполнение энергетических уровней и подуровней электронами происходит по энергетическому ряду орбиталей, а не по порядку. Рекомендую повторить его еще раз. Таким образом, формула калия:
+19K 1s22s22p63s23p64s11s 2s 2p3s 3p4s
Для записи дальнейших электронных формул в статье будем использовать сокращенную форму:
+19K 4s1 4s
У кальция 4s-подуровень заполнен:
+20Ca 4s2 4s
У элемента 21, скандия, согласно энергетическому ряду орбиталей, начинается заполнение 3d-подуровня:
+21Sc 3d14s2 4s 3d
Дальнейшее заполнение 3d-подуровня происходит согласно квантовым правилам, от титана до ванадия:
+22Ti 3d24s2 4s 3d
+23V 3d34s2 4s 3d
Однако, у следующего элемента порядок заполнения орбиталей нарушается. Электронная конфигурация хрома такая:
+24Cr 3d54s1 4s 3d
В чём же дело? А дело в том, что при «традиционном» порядке заполнения орбиталей (соответственно, неверном в данном случае — 3d44s2) ровно одна ячейка в d-подуровне оставалась бы незаполненной. Оказалось, что такое заполнение энергетически менее выгодно. А более выгодно, когда d-орбиталь заполнена полностью, хотя бы единичными электронами. Этот лишний электрон переходит с 4s-подуровня. И небольшие затраты энергии на перескок электрона с 4s-подуровня с лихвой покрывает энергетический эффект от заполнения всех 3d-орбиталей. Этот эффект так и называется — «провал» или «проскок» электрона. И наблюдается он, когда d-орбиталь недозаполнена на 1 электрон (по одному электрону в ячейке или по два).
У следующих элементов «традиционный» порядок заполнения орбиталей снова возвращается. Конфигурация марганца:
+25Mn 3d54s2
Аналогично у кобальта и никеля. А вот у меди мы снова наблюдаем провал (проскок) электрона — электрон опять проскакивает с 4s-подуровня на 3d-подуровень:
+29Cu 3d104s1
На цинке завершается заполнение 3d-подуровня:
+30Zn 3d104s2
У следующих элементов, от галлия до криптона, происходит заполнение 4p-подуровня по квантовым правилам. Например, электронная формула галлия:
+31Ga 3d104s24p1
Формулы остальных элементов мы приводить не будем, можете составить их самостоятельно.
Некоторые важные понятия:
Внешний энергетический уровень — это энергетический уровень в атоме с максимальным номером, на котором есть электроны.
Например, у меди (3d104s1) внешний энергетический уровень — четвёртый.
Валентные электроны — электроны в атоме, которые могут участвовать в образовании химической связи. Например, у хрома (+24Cr 3d54s1) валентными являются не только электроны внешнего энергетического уровня (4s1), но и неспаренные электроны на 3d-подуровне, т.к. они могут образовывать химические связи.
Ядро атома. Изотопы
Атом состоит из ядра, которое имеет положительный заряд, и электронов, которые имеют отрицательный заряд. В целом атом электронейтрален.
Положительный заряд ядра атома равен порядковому номеру химического элемента.
Ядро атома — сложная частица. В ней сосредоточена почти вся масса атома. Поскольку химический элемент — совокупность атомов с одинаковым зарядом ядра, то около символа элемента указывают (рис. 6).
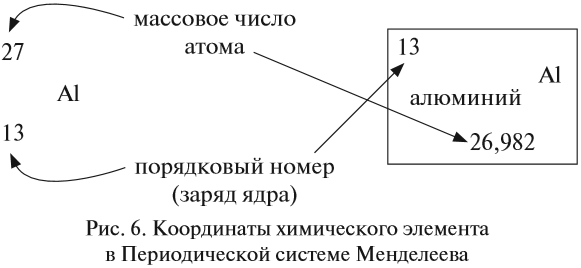
По этим данным можно определить состав ядра. Ядро состоит из протонов и нейтронов.
- Протон (р) имеет массу, равную 1 (1,0073 а. е. м.) и заряд, равный +1.
- Нейтрон (n) заряда не имеет (нейтрален), а масса его приблизительно равна массе протона (1,0087 а. е. м.).
Какие частицы определяют заряд ядра? Протоны! Причём число протонов равно (по величине) заряду ядра атома, т. е. порядковому номеру:
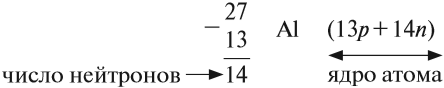
Число нейтронов определяют по разности между величинами: «масса ядра» и «порядковый номер».
Задание 3.3. Определите состав ядер атомов, если химический элемент находится в:
- 3-м периоде, VII группе, главной подгруппе;
- 4-м периоде, IV группе, побочной подгруппе;
- 5-м периоде, I группе, главной подгруппе.
Обратите внимание, что при определении массового числа ядра атома приходится округлять атомную массу, указанную в Периодической системе! Почему? Ведь массы протона и нейтрона практически целочисленны, а массой электронов можно пренебречь. Для того,чтобы ответить на этот вопрос, нужно понять:
Для того,чтобы ответить на этот вопрос, нужно понять:
- Что происходит с атомом в ходе химических процессов;
- Что такое «химический элемент».
В химических процессах обязательно изменяется распределение электронов вокруг ядра или даже изменяется их число. В последнем случае атом отдаёт или принимает электроны и превращается в заряженную частицу — ион. Но в химических реакциях никогда не меняется состав ядра атома, его заряд. Поэтому заряд ядра атома является своеобразным «паспортом» химического элемента.
Химический элемент — совокупность атомов или ионов с одинаковым зарядом ядра.
Для того чтобы разобраться, попробуйте определить, какие из ядер, состав которых указан ниже, принадлежат одному и тому же химическому элементу:
Атомам одного химического элемента принадлежат ядра А и В, так как они содержат одинаковое число протонов, т. е. заряд этих ядер одинаковый. Но ведь у них разная масса! Исследования показывают, что масса атома не оказывает существенного влияния на его химические свойства. Поэтому атомы одного и того же химического элемента (одинаковое число протонов), но с разной массой (разное число нейтронов) являются ИЗОТОПАМИ* этого элемента.
В таблице Менделеева указана средняя атомная масса всех природных изотопов данного элемента (Аr). Изотопы и их химические соединения отличаются друг от друга по физическим свойствам, но химические свойства у изотопов одного химического элемента одинаковы. Так, изотоп углерода-14 (14С) имеет такие же химические свойства, как и углерод-12 (12С), который входит в ткани любого живого организма, отличаясь от него только радиоактивностью. Поэтому изотопы применяют для диагностики и лечения различных заболеваний, для научных исследований.
Элемент «водород» встречается в природе в виде трёх изотопов:
![]()
Химический элемент «кислород» также представлен тремя природными изотопами:
Задание 3.4. Укажите состав ядер этих изотопов водорода и кислорода.
Если разные вещества содержат атомы одного и того же химического элемента, это не означает, что эти вещества имеют одни те же свойства. Например, химический элемент «хлор» в виде атомарного хлора Cl• разрушает метан, а также атмосферный озон. Тот же элемент в виде молекулярного хлора Cl2 ядовит, активно реагирует с водой, многими металлами, а ионы хлора (химический элемент — тот же!) в составе NaCl химически инертен, а с биологической точки зрения не только безвреден, но и полезен для нас. Эти ионы являются макроэлементами нашей пищи, которые входят в состав крови, желудочного сока. Суточная потребность — до 6 граммов.
Но вернемся к описанию строения атома.

Теория обменного взаимодействия
В первой трети прошлого столетия у исследователей появилась гипотеза о том, что все взаимодействия в мире элементарных частиц осуществляются посредством обмена квантами какого-либо поля. Выдвинули эту гипотезу советские ученые И.Е. Тамм и Д.Д. Иваненко. Они провели параллели между взаимодействиями, которые возникают в результате обмена частицами, и обменом валентными электронами, которые при образовании ковалентной химической связи объединяются на незаполненных электронных оболочках.
Определение 11
Обменное взаимодействие – это взаимодействие, которое осуществляется путем обмена частицами.
Определение 12
Электромагнитное взаимодействие, которое наблюдается между заряженными частицами, сопровождается обменом фотонами, квантами электромагнитного поля.
Подтверждением верности теории обменного взаимодействия стали теоретические выкладки японского физика Х. Юкавы, который доказал, что сильное взаимодействие между нуклонами можно объяснить обменом гипотетическими частицами, которые получили название мезонов. Юкава вычислил массу этих частиц. Она оказалась приблизительно равно 300 электронным массам.
Спустя несколько лет частицы с такой массой действительно были обнаружены. Они были названы π-мезонов (пионов). В настоящее время известны три вида пионов: π+, π- и π.
Теория электрослабого взаимодействия рассматривает электромагнитное поле и поле слабого взаимодействия как две разные характеристики одного поля. В таком поле помимо квантов взаимодействие обеспечивают и векторные бозоны.


































