История
Свою историю гидриды начинают с открытия водорода. Этот элемент ещё в 18 веке нашел Водород, как известно, входит в и является основой всех остальных элементов таблицы Менделеева. Благодаря ему возможно существование органических соединений и жизни на нашей планете.
Кроме того, водород является основой и для многих неорганических соединений. В их числе кислоты и щёлочи, а также уникальные бинарные соединения водорода с другими элементами — гидриды. Дата их первого синтеза точно неизвестна, но гидриды неметаллов были известны человеку ещё с древности. Самый распространенный из них — вода. Да, вода — это гидрид кислорода.
Также к этому классу относят аммиак (основной компонент нашатырного спирта), сероводород, хлороводород и им подобные соединения. Более подробно о свойствах веществ из этого многообразного и удивительного класса соединений мы поговорим в следующем разделе.

Нахождение в природе, изучение его свойств
Звездная температура позволяет водороду существовать в виде плазмы. Она составляет около 6000°С. Однако пространство между звездами заполнено отдельными молекулами, атомами и ионами, часто образующими молекулярные скопления различных размеров и форм – облака. Плотность вещества не является постоянной величиной, как и его температура.
В земной коре водород считается десятым по распространенности элементом. Его массовая доля составляет 1%. При этом она достигает 17% по количеству атомов. Это второе место после кислорода, доля которого составляет 52%. Отсюда важная роль водорода в природе, особенно в химических превращениях.
Водород, в отличие от кислорода, не может существовать в свободном состоянии, только в связанном. Исключение составляет атмосфера, в сухом остатке которой находится 0,00005 % простого вещества — водорода.
Все органические вещества содержат водород. Его доля в живых клетках велика (по числу атомов его удельный вес достигает 63%).
В составе воды водород имеет большое значение в ходе геохимических процессов. Поэтому вулканические газы вызывают выделение некоторого количества водорода по разломам (причина — рифтогенез). По этой же причине водород часто встречается в районе угольных месторождений.
Природные минералы могут содержать H2 в виде ионов аммония, гидроксильных ионов и воды.
Причина появления молекул Н2 в атмосфере – разложение формальдегида, участника окисления метана и других органических соединений. Также причиной их образования является неполное сгорание топлива и биомассы, фиксация азота некоторыми микроорганизмами, содержащимися в воздухе.
Молекулы водорода легкие, поэтому они имеют высокую тепловую скорость. Попадая в верхние слои атмосферы, такие молекулы часто улетают в космос, при этом их потери могут достигать 3 кг в секунду.
Способы завершения энергетического уровня
Водород — один из немногих химических элементов, который может иметь как положительную, так и отрицательную степень окисления в соединениях. Как, например, бром ( NaBr -1, Br +1 2O ) и хлор ( NaCl -1, HClO3+5):
- Может принимать на внешний уровень один недостающий электрон – атом водорода превращается в ион, заряженный отрицательно. Такая реакция происходит при взаимодействии с металлами, которые в соединениях проявляют только положительную степень окисления. Степень окисления водорода будет равна -1, так как заряд отрицательный. Металлы с H2 создают соединения, которые называются гидридами. Способствует их образованию H2 с самыми активными металлами: щелочными и щелочноземельными. Например: NaH (гидрид натрия), CaH2 (гидрид кальция), LiH (гидрид лития), CuH (гидрид меди).
- Может отдавать один электрон со своего внешнего энергетического уровня — остается только ядро атома водорода, состоящее из протона. Таким образом, H2 образует химические соединения с неметаллами, которые при этом будут проявлять только отрицательную степень окисления. В соединениях с водородом степень окисления неметалла будет низшая. В этом случае водород становится частицей с положительным зарядом иона или степенью окисления +1. Соединения H2 с неметаллами называют летучие водородные соединения. Например: HCl (соляная кислота/хлороводород), NH3 (водородное соединение азота — аммиак), NH4OH (нашатырный спирт), NaHS (гидросульфид натрия).
Магний по своим свойствам и химической связи располагается между ионными и ковалентными гидридами. С водой и водными растворами MgH2 реагирует с выделением H2, но не так энергично, как ионные гидриды.
Соединения железа с водородом крайней неустойчивы и в чистом виде не обнаружены. Формула неустойчивого гидрида железа выглядит так: C5H5Fe.
Металлические соединения
Металлические — соединения переходных металлов. Фактически они являются твёрдым раствором H2 в металле, атомы водорода помещаются в кристаллическую решётку металла. Их образованию всегда способствует адсорбция водорода на поверхности металла.
Физические свойства: представляют собой кристаллические вещества с металлическим блеском. Обладают интенсивной окраской, проявляют металлические или полупроводниковые свойства. Устойчивы на воздухе. С кислородом и водой реагируют медленно. Магнитными, механическими, тепло- и электропроводными свойствами схожи с металлами.
Химическая связь очень прочная.
Применение: применяются в качестве источников водорода особой чистоты (который используется в топливных элементах), также для удаления водорода из газовых смесей.
Получение: реакция металла с водородом при обычной температуре или при нагревании: Ti + H2 = (150-200°С) TiH2.
При взаимодействии H2 с интерметаллическими соединениями, такими как TiFe, LaNi5, можно получить гидриды интерметаллидов TiFeH2, LaNi5H6, которые с высокой скоростью обратимо поглощают водород при атмосферном давлении.
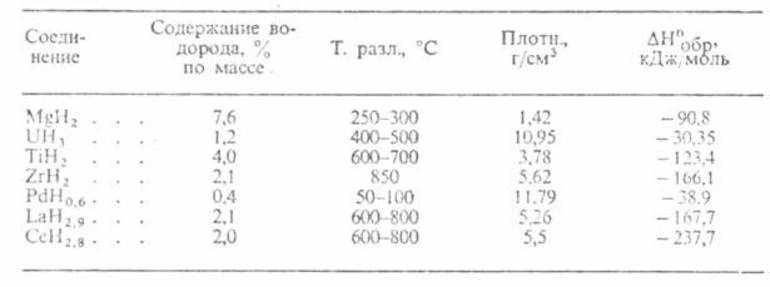
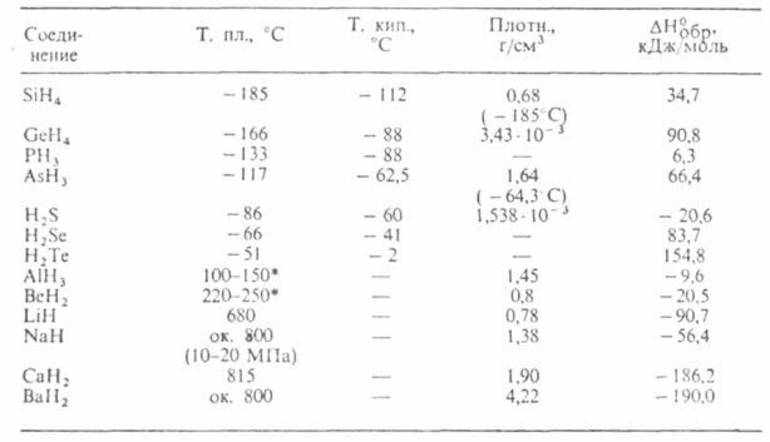
В прикрепленных таблицах указано содержание водорода, температура разложения, плотность и пр., что поможет в более глубоком понимании физических свойств водорода разных типов гидридов.
Гидрид элемента основной группы
Показаны гидриды основных элементов.
| химическая формула | Название организации ИЮПАК | распространенное имя | группа элементов | Физические характеристики |
|---|---|---|---|---|
| ЧД 3 | Боран _ | Боргидрид _ |
Существует в виде диборана . Существуют различные типы боранов, кроме диборана. |
|
| Ч. 4 | Карбейн | Метан _ |
Температура плавления −183°С, температура кипения −162°С. Бесцветный газ с удельной плотностью 0,555. Регистрационный номер CAS 74-82-8. Статьи, знакомые с метаном . |
|
| НХ 3 | Азанэ | Аммиак _ |
Температура плавления -74°С, температура кипения -33,4°С. Относительная плотность 0,597. Бесцветный газ. Регистрационный номер CAS 7884-41-7. Статья Я знаком с аммиаком . |
|
| Н 2 О | оксидан | вода _ | Элементарный гидрид группы 16 (кислородная группа или халькоген) |
Бесцветная жидкость с температурой плавления 0°С, температурой кипения 100°С и удельной плотностью 1,0. Регистрационный номер CAS 7732-18-5. Статьи, знакомые с водой . |
| ВЧ | Фторид водорода , фторан | галогеноводород | Температура плавления −83 °С, температура кипения 19,5 °С. Относительная плотность 0,99. Бесцветная жидкость или газ. Плавиковая кислота при растворении в воде | |
| АлН 3 | Алан (алан) | Гидрид алюминия | ||
| SiH 4 | Силан _ | Гидрид кремния | ||
| РН 3 | Фосфан | Фосфин (фосфид водорода) | Температура плавления −133°С, температура кипения −87,7°С. Бесцветный газ. Регистрационный номер CAS 7803-51-2. |
|
| Ч 2 С | сульфан | Сероводород _ | Элементарный гидрид группы 16 (кислородная группа) | Температура плавления -85,5°С, температура кипения -60,7°С. Бесцветный газ. |
| HCl | Хлористый водород , хлоран | галогеноводород |
Температура плавления −114 °С, температура кипения −85 °С. Бесцветный газ. Водный раствор представляет собой соляную кислоту . |
|
| GaH 3 | Галлан | Гидрид галлия | ||
| ГеГ 4 | немецкий | гидрид германия | ||
| АзН 3 | Арсан | Арсин _ | Температура плавления -116,3°С, температура кипения -55°С. Бесцветный газ. Регистрационный номер CAS 7784-42-1. |
|
| H 2 Se | Селане | Селенид водорода | Элементарный гидрид группы 16 (кислородная группа) |
Температура плавления -66°С, температура кипения -41°С, молекулярная масса 81,0, бесцветный газ. Он имеет чесночный аромат и токсичен . |
| HBr | Бромоводород , броман | галогеноводород | Температура плавления -86°С, температура кипения -66,4°С. Бесцветный газ. |
|
| InH 3 | гидрид индия | |||
| СН 4 | Станнан _ | гидрид олова | ||
| СБН 3 | Стибане | Стибин , гидрид сурьмы | ||
| Н 2 Те | Теллурид _ | Теллурид водорода | Элементарный гидрид группы 16 (кислородная группа) |
Температура плавления -49°С, температура кипения -2°С. Статьи, знакомые с теллуридом водорода . |
| ПРИВЕТ | Йодоводород (йодан) | галогеноводород | Температура плавления -81°С, температура кипения -36°С. Бесцветный газ. |
|
| ТлН 3 | Гидрид таллия (III) (тригидрид таллия) | |||
| PbH 4 | Ум ル ン ンpl (плюмбан) | Гидрид свинца | ||
| БиГ 3 | висмутан | Висмутин , гидрид висмута ( гидрид висмута ) |
出典: Номенклатура органической химии IUPAC / Рекомендации 1979 г. и Рекомендации 1993 г., ACD Lab. Инк 他
Использование водорода
В химической промышленности водород используют при производстве аммиака, мыла и пластмасс. В пищевой промышленности с помощью водорода из жидких растительных масел делают маргарин. Водород очень лёгок и в воздухе всегда поднимается вверх. Когда-то дирижабли и воздушные шары наполняли водородом. Но в 30-х гг. XX в. произошло несколько ужасных катастроф, когда дирижабли взрывались и сгорали. В наше время дирижабли наполняют газом гелием. Водород используют также в качестве ракетного топлива. Когда-нибудь водород, возможно, будут широко применять как топливо для легковых и грузовых автомобилей. Водородные двигатели не загрязняют окружающей среды и выделяют только водяной пар (правда, само получение водорода приводит к некоторому загрязнению окружающей среды). Наше Солнце в основном состоит из водорода. Солнечное тепло и свет — это результат выделения ядерной энергии при слиянии ядер водорода.
Использование водорода в качестве топлива (экономическая эффективность)
Важнейшей характеристикой веществ, используемых в качестве топлива, является их теплота сгорания. Из курса общей химии известно, что реакция взаимодействия водорода с кислородом происходит с выделением тепла. Если взять 1 моль H2 (2 г) и 0,5 моль O2 (16 г) при стандартных условиях и возбудить реакцию, то согласно уравнению
- Н2 + 0,5 О2= Н2О
после завершения реакции образуется 1 моль H2O (18 г) с выделением энергии 285,8 кДж/моль (для сравнения: теплота сгорания ацетилена составляет 1300 кДж/моль, пропана — 2200 кДж/моль). 1 м³ водорода весит 89,8 г (44,9 моль). Поэтому для получения 1 м³ водорода будет затрачено 12832,4 кДж энергии. С учётом того, что 1 кВт·ч = 3600 кДж, получим 3,56 кВт·ч электроэнергии. Зная тариф на 1 кВт·ч электричества и стоимость 1 м³ газа, можно делать вывод о целесообразности перехода на водородное топливо.
Например, экспериментальная модель Honda FCX 3 поколения с баком водорода 156 л (содержит 3,12 кг водорода под давлением 25 МПа) проезжает 355 км. Соответственно из 3,12 кг H2 получается 123,8 кВт·ч. На 100 км расход энергии составит 36,97 кВт·ч. Зная стоимость электроэнергии, стоимость газа или бензина, их расход для автомобиля на 100 км легко подсчитать отрицательный экономический эффект перехода автомобилей на водородное топливо. Скажем (Россия 2008), 10 центов за кВт·ч электроэнергии приводят к тому, что 1 м³ водорода приводят к цене 35,6 цента, а с учётом КПД разложения воды 40-45 центов, такое же количество кВт·ч от сжигания бензина стоит 12832,4кДж/42000кДж/0,7кг/л*80центов/л=34 цента по розничным ценам, тогда как для водорода мы высчитывали идеальный вариант, без учёта транспортировки, амортизации оборудования и т. д. Для метана с энергией сгорания около 39 МДж на м³ результат будет ниже в два-четыре раза из-за разницы в цене (1м³ для Украины стоит 179$, а для Европы 350$). То есть эквивалентное количество метана будет стоить 10-20 центов.
Однако не следует забывать того, что при сжигании водорода мы получаем чистую воду, из которой его и добыли. То есть имеем возобновляемый запасатель энергии без вреда для окружающей среды, в отличие от газа или бензина, которые являются первичными источниками энергии.
Приложения
Трис (триметилсилил) силан является примером гидрида со слабой связью с Н. Он используется в качестве источника атомов водорода.
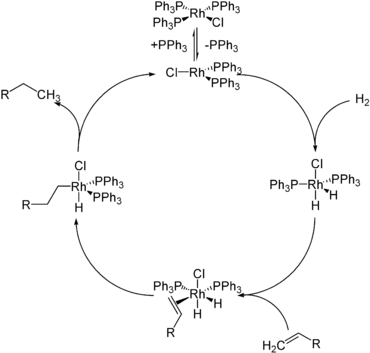
Гидриды металлов (например, H 2 RhCl (PPh 3 ) 2, полученный из катализатора Уилкинсона ) являются промежуточными продуктами в катализе гидрирования.
- Гидриды , такие как боргидрид натрия , алюмогидрид лития , гидрид диизобутилалюминия (DIBAL) и супер гидрид , обычно используются в качестве восстанавливающих агентов в химическом синтезе . Гидрид присоединяется к электрофильному центру, обычно ненасыщенному углероду.
- Гидриды , такие как гидрид натрия и гидрид калия используются в качестве сильных оснований в органическом синтезе . Гидрид реагирует со слабой кислотой Бренстеда с выделением H 2 .
- Гидриды, такие как гидрид кальция , используются в качестве осушителей , то есть осушающих агентов, для удаления следов воды из органических растворителей. Гидрид реагирует с водой, образуя водород и гидроксидную соль. Затем сухой растворитель можно перегонять или переносить под вакуумом из «емкости для растворителя».
- Гидриды важны в технологиях аккумуляторных батарей, таких как никель-металлогидридные батареи . Различные гидриды металлов были исследованы для использования в качестве средств хранения водорода в электромобилях, работающих на топливных элементах, и для других целей водородной экономии .
Гидридные комплексы являются катализаторами и каталитическими промежуточными продуктами в различных гомогенных и гетерогенных каталитических циклах. Важные примеры включают катализаторы гидрирования , гидроформилирования , гидросилилирования , гидрообессеривания . Даже некоторые ферменты, гидрогеназа , действуют через промежуточные гидриды. Никотинамид-адениндинуклеотид энергоносителя реагирует как гидрид-донор или гидридный эквивалент.
Соединения с ионным типом связи
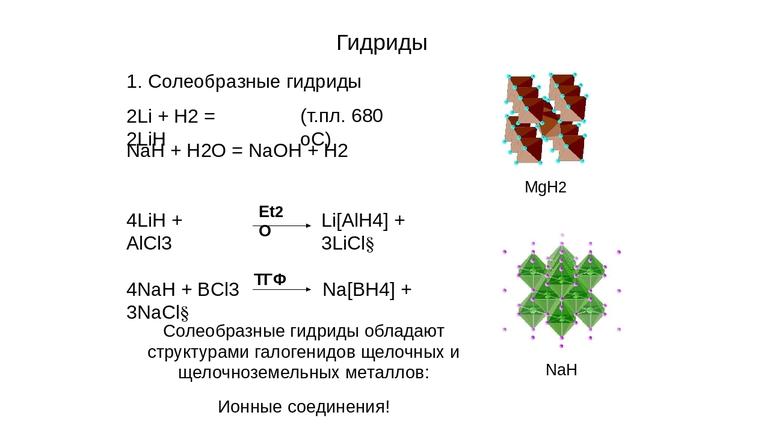
Их образует водород с металлами 1А и 2А групп, кроме Mg, а также с Al. Они отчасти показывают свойства соответствующих галогенидов, откуда и появилось второе наименование — солеобразные.
Это химические соединения, такие как гидрид натрия (NaH), кальция (CaH2), лития, с формулой LiH, другие. Для них характерно:
- Получают при высокой температуре и под давлением.
- В этих соединениях, проявляющих, как правило, щелочные свойства, у водорода степень окисления -1. С металлами 1А и 2А групп, такими, как Na, Li, Be, K, Rb, Sr он выступает окислителем, подобно галогенам. Например, гидрид натрия, с химической формулой NaH — в этом соединении ион водорода имеет отрицательный заряд.
- Это кристаллические вещества белого цвета, с ионной решёткой, структура подобна строению соответствующего галогенида.
- При нормальных условиях устойчивы.
- Распад на металл и водород при нагреве, минуя этап плавления (исключением является LiH, его температура плавления 688 градусов Цельсия).
- В расплаве — хорошие проводники, при этом на аноде будет выделяться H2.
- Вспыхивают при растирании на воздухе.
- Все являются сильными восстановителями. Применяются для получения чистых металлов из солей и оксидов, для удаления окалины, коррозии.
- Реагируют с оксидом углерода, формируют соли муравьиной кислоты (формиаты).
- Как и соли, могут участвовать в обменных реакциях, гидролизе.
Солеобразными бывают не только бинарные (простые) соединения водорода. Дигидриды, образуемые добавлением групп бора (BH4) или алюминия (AlH4) к металлу, также имеют ионный тип связи.
По химической природе такие соединения ведут себя как основные. Ионные гидриды обладают высокой химической активностью. Они бурно реагируют с кислородом и H2O в парообразном состоянии.
Но выраженный ионный характер — свойство, проявляемое соединениями кальция, натрия, щелочных и щёлочноземельных элементов. На них проще всего и нагляднее можно показать химию взаимодействий этих веществ:
- С водой: 2NaH + H2O = 2NaOH + H2O.
- С кислородом: NaH + O2 = NaO + H2O.
- Реакция разложения: CaH2 = Ca + H2.
- С оксидами углерода: NaH + CO2 = NaCOOH.
- Кремния: 4NaH + 3SiO2 = 2Na2SiO3 + Si + 2H2.
- Металлов: 4NaH + Fe3O4 = 4NaOH + 3Fe.
- Восстановление: 2NaH + 2SO2 = Na2SO4 + H2S.
- С аммиаком: NaH + NH3 = NaNH2 + H2.
- С кислотами: 2NaH + H2SO4 = Na2SO4 + 2H2.
- Со спиртами: KH + HO-R = KOR + H2.
По свойствам и природе связи промежуточное положение между ионными и ковалентными занимает гидрид магния, с формулой MgH2.
Соли и оксиды калия, кальция, меди и других щелочных и щёлочноземельных металлов образуют с гидридом кислорода (водой) ещё один вид соединений — дигидраты. Это соли серной кислоты (сульфаты), галогениды, оксиды плюс 2 присоединённых молекулы H2O. Формула алебастра — Ca5O4 плюс 2H2O, гипс — CaSO4 плюс 2H2O, в природе они не редкость.
Химические свойства
В этом разделе также стоит поделить гидриды на те же группы, что и в прошлом. И начнём мы со свойств ионных гидридов. Их основное отличие от двух других видов в том, что они активно взаимодействуют с водой с образованием щёлочи и выделением водорода в виде газа. Реакция гидрид — вода довольно взрывоопасна, поэтому соединения чаще всего хранят без доступа влаги. Это делается потому, что вода, даже содержащаяся в воздухе, может инициировать опасное превращение.
Покажем уравнение вышеописанной реакции на примере такого вещества, как гидрид калия:
KH + H 2 O = KOH + H 2
Как мы можем видеть, всё достаточно просто. Поэтому рассмотрим более интересные реакции, характерные для двух других видов описываемых нами веществ.
В принципе, остальные превращения, что мы не разобрали, характерны для всех типов веществ. Они склонны взаимодействовать с оксидами металлов, образуя металл, либо с водой, либо с гидроксидом (последнее характерно для щелочных и щёлочно-земельных металлов).
Ещё одна интересная реакция — термическое разложение. Оно происходит при высоких температурах и проходит до образования металла и водорода. Не будем останавливаться на этой реакции, так как уже разбирали её в предыдущих разделах.
Итак, мы рассмотрели свойства этого вида бинарных соединений. Теперь стоит поговорить об их получении.

Цитированные источники [ править ]
| vтеСоединения натрия |
|---|
|
| Химические формулы |
| vтеБинарные соединения водорода | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Гидриды щелочных металлов (Группа 1) |
|
Гидрид лития, ионный гидрид металла LiH Гидрид бериллия Слева (газовая фаза): ковалентный гидрид металла BeH 2 Справа: (BeH 2 ) n (твердая фаза) полимерный гидрид металла Боран и диборан Слева: BH 3 (особые условия), гидрид ковалентного металлоида Справа : B 2 H 6 (стандартные условия), димерный гидрид металлоида метан, ковалентный гидрид неметалла CH 4 Аммиак, ковалентный гидрид неметалла NH 3 Вода, ковалентный гидрид неметалла H 2 O Фтористый водород, HFковалентный гидрид неметалла | |||||||||||||||||||
| Щелочная (группа 2) земля гидриды |
|
||||||||||||||||||||
| Группа 13 гидриды |
|
||||||||||||||||||||
| Группа 14 гидридов |
|
||||||||||||||||||||
| Гидриды пниктогена (группа 15) |
|
||||||||||||||||||||
| Халькогениды водорода (гидриды 16 группы) |
|
||||||||||||||||||||
| Галогениды водорода (гидриды группы 17) |
ВЧ HCl HBr ЗДРАВСТВУЙ Шляпа |
||||||||||||||||||||
| Гидриды переходных металлов |
|
||||||||||||||||||||
| Гидриды лантаноидов |
|
||||||||||||||||||||
| Гидриды актинидов |
|
Приложение по номенклатуре
Протид , дейтерид и тритид используются для описания ионов или соединений, содержащих обогащенный водород-1 , дейтерий или тритий соответственно.
В классическом значении гидрид относится к любым соединениям водорода, образуемым с другими элементами, в пределах групп 1–16 ( бинарные соединения водорода ). Ниже приводится список номенклатуры гидридных производных соединений основной группы в соответствии с этим определением:
щелочные и щелочноземельные металлы: гидрид металла
бор : боран , BH 3
алюминий : алюминий , AlH 3
галлий : галлан , GaH 3
индий : индиган , InH 3
таллий : таллан , TlH 3
углерод : алканы , алкены , алкины и все углеводороды
кремний : силан
германий : герман
олово : станнан
свинец : плюмбан
азот : аммиак («азан» при замещении ), гидразин.
фосфор : фосфин (обратите внимание: «фосфан» — это рекомендованное ИЮПАК название)
мышьяк : арсин (обратите внимание: «арсан» — это рекомендованное ИЮПАК название)
сурьма : стибин (обратите внимание: «стибан» — это название, рекомендованное ИЮПАК )
висмут : висмутин (обратите внимание: «висмутан» — это рекомендованное ИЮПАК название)
гелий : гидрид гелия (существует только в виде иона)
Согласно вышеприведенному соглашению, следующие являются «водородными соединениями», а не «гидридами»:
- кислород : вода («оксидан» при замещении; синоним: гидрид кислорода), пероксид водорода.
- сера : сероводород («сульфан» при замещении) синоним: гидрид серы
- селен : селенид водорода («селан» при замещении)
- теллур : теллурид водорода («теллан» при замещении)
- полоний : полонид водорода («полан» при замене)
- галогены : галогениды водорода
Примеры:
- никель-гидрид : используется в NiMH батареях
- гидрид палладия : электроды в экспериментах по холодному синтезу
- литийалюминийгидрид : мощный восстановитель, используемый в органической химии
- боргидрид натрия : селективный специальный восстановитель, хранение водорода в топливных элементах
- гидрид натрия : мощное основание, используемое в органической химии
- диборан : восстановитель, ракетное топливо, полупроводниковая легирующая добавка, катализатор, используемый в органическом синтезе; также боран , пентаборана и декаборана
- арсин : используется для легирования полупроводников
- Стибин : используется в полупроводниковой промышленности
- фосфин : используется для фумигации
- силан : многие промышленные применения, например, производство композиционных материалов и гидрофобизаторов.
- аммиак : охлаждающая жидкость , топливо , удобрения , многие другие промышленные применения
- сероводород : компонент природного газа , важный источник серы
- Химически даже воду и углеводороды можно рассматривать как гидриды.
Все гидриды металлоидов легко воспламеняются. Все твердые неметаллические гидриды, кроме льда , легко воспламеняются. Но когда водород соединяется с галогенами, он производит кислоты, а не гидриды, и они не горючие.
Соглашение о приоритете
Согласно соглашению IUPAC , по приоритету (стилизованная электроотрицательность) водород находится между элементами группы 15 и группы 16 . Следовательно, у нас есть NH 3 , «гидрид азота» (аммиак), по сравнению с H 2 O, «оксид водорода» (вода). Это соглашение иногда нарушается для полония, который на основании металличности полония часто называют «гидридом полония» вместо ожидаемого «полонида водорода».


































