Взаимодействие с кислородом
Многие металлы могут вступать в реакцию с кислородом. Обычно продуктами этих реакций являются оксиды, но есть и исключения, о которых вы узнаете на следующем уроке. Рассмотрим взаимодействие магния с кислородом.
Магний горит в кислороде, при этом образуется оксид магния:
2Mg + O2 = 2Mg+2O-2
Рис. 1. Горение магния в кислороде
Атомы магния отдают свои внешние электроны атомам кислорода: два атома магния отдают по два электрона двум атомам кислорода. При этом магний выступает в роли восстановителя, а кислород – в роли окислителя.
Видео-опыт: “Горение магния”
Обратите внимание!!! Серебро, золото и платина с кислородом не реагируют. 2
Взаимодействие с галогенами, образуются галогениды
2. Взаимодействие с галогенами, образуются галогениды
Для металлов характерна реакция с галогенами. Продуктом такой реакции является галогенид металла, например, хлорид.
Рис. 2. Горение калия в хлоре
Калий сгорает в хлоре образованием хлорида калия:
2К + Cl2 = 2K+1Cl-1
Два атома калия отдают молекуле хлора по одному электрону. Калий, повышая степень окисления, играет роль восстановителя, а хлор, понижая степень окисления,- роль окислителя
3. Взаимодействие с серой
Многие металлы реагируют с серой с образованием сульфидов. В этих реакциях металлы также выступают в роли восстановителей, тогда как сера будет окислителем. Сера в сульфидах находится в степени окисления -2, т.е. она понижает свою степень окисления с 0 до -2. Например, железо при нагревании реагирует с серой с образованием сульфида железа (II):
Fe + S = Fe+2S-2
Рис. 3. Взаимодействие железа с серой
Видео-опыт: “Взаимодействие цинка с серой”
Металлы также могут реагировать с водородом, азотом и другими неметаллами при определенных условиях.
4. Взаимодействие с водой
Металлы по — разному реагируют с водой:
Помните!!!
Алюминий реагирует с водой подобно активным металлам, образуя основание:
Видео-опыт: “Взаимодействие натрия с водой”
Раскалённое железо реагирует с водяным паром, образуя смешанный оксид — железную окалину Fe3O4 и водород: 3Fe+4H+12O−2 → Fe+2O−2⋅Fe+32O−23 + 4H2
5. Взаимодействие с кислотами
Металлы особо реагируют с серной концентрированной и азотной кислотами:
H2SO4 (конц.) + Me = соль + H2O + Х
|
Щелочные и щелочноземельные |
Fe, Cr, Al |
Металлы до водорода Сd-Pb |
Металлы после водорода (при t) |
Au, Pt |
|
|
X |
1)пассивируются на холоде; |
S↓ могут H2S илиSO2 |
— |
H2SO4 (разб) + Cu ≠
Внимание!
Pt, Au + H2SO4 (конц.) →реакции нет
Al, Fe, Cr + H2SO4 (конц.) холодная→ пассивация
Интересные факты
- Самым твердым металлом на Земле является хром. Этот голубовато-белый метал был открыт в 1766 году под Екатеринбургом.
- И наоборот, самыми мягкими металлами являются алюминий, серебро и медь. Благодаря своей мягкости они нашли широкое применение в разных областях, например, в электроаппаратостроении.
- Золото – которое на протяжении веков было самим драгоценным металлом имеет и еще одно любопытное свойство – это самый пластичный металл на Земле, обладающий к тому же отличной тягучестью и ковкостью. Также золото не окисляется при нормальной температуре (для этого его нужно нагреть до 100С), обладает высокой теплопроводностью и влагоустойчивостью. Наверняка все эти физические характеристики делают настоящее золото таким ценным.
- Ртуть – уникальный металл, прежде всего тем, что он единственный из металлов, имеющий жидкую форму. Причем в природных условиях ртути в твердом виде не существует, так как ее температура плавления -38С, то есть в твердом состоянии она может существовать в местах, где просто таки очень холодно. А при комнатной температуре 18С ртуть начинает испаряться.
- Вольфрам интересен тем, что это самый тугоплавкий металл в мире, чтобы он начал плавиться нужна температура 3420С. Именно по этой причине в электрических лампочках нити накаливания, принимающие основной тепловой удар, изготовлены из вольфрама.
Нахождение металлов в природе
Металлы с низкой химической
активностью (Cu, Ag, Au, Pt, Hg) встречаются в виде свободных включений в
породах. Большинство металлов встречается в природе в виде руд и соединений.
Они образуют оксиды, сульфиды, карбонаты и другие химические вещества. Для того,
чтобы извлечь чистые металлы и использовать их дальше, необходимо отделить и
очистить их от руд. При необходимости выполнять сплавы и другую обработку
металлов. Это исследуется наукой металлургии, которая различает руды черных
металлов (на основе железа) и цветных металлов (в них нет железа, всего около
70 элементов). Исключение составляют около 16 элементов: так называемые
драгоценные металлы (золото, серебро и т.д.) и некоторые другие (например,
ртуть, медь), которые присутствуют без примесей.
Они также присутствуют в
небольших количествах в морской воде (1,05% — 0,12%), растениях и живых
организмах (которые играют важную роль).
Таким образом, содержание
некоторых металлов в земной коре следующее: алюминий — 8,2%, железо — 4,1%,
кальций — 4,1%, натрий — 2,3%, магний — 2,3%, калий — 2,1%, титан — 0,56%.
Металлы встречаются в природе:
- в своем первоначальном состоянии: серебро, золото, платина, медь, иногда ртуть.
- в виде оксидов: магнетит Fe3O4, гематит Fe2O3 и др.
- в виде смешанных оксидов: Каолин АІ2О3 — 2SiO2 — 2H2O, алунит (Na,K)2O — АІО3 — 2SiO2 и др.
- различных солей:
- Сульфиды: PbS галенит, NgS киноварь,
- Хлориды: сильвинит KS1, NaCl-галогенит, сильвинит KSl-NaCl, карналлит KSl — MgSl2 — 6H2O,
- Сульфаты: барит Vaso4, ангидрид Ca8O4
- Фосфат: апатит Ca3(RO4)2,
- Карбонаты: мел, мрамор SASO3, магнезит MgSO3.
Большая часть алюминия
сконцентрирована в алюмосиликатах, из которых наиболее распространены полевые
шпаты. Их важнейшими представителями являются ортоклазовые минералы K
, альбит Na и анорит Ca . Очень распространены
минералы слюдяной группы, например, мусковит Kal22 и нефелин (Na,
K)2 (используются для производства оксида алюминия, содовых изделий и
цемента). Среди других минералов наиболее часто используются бокситы Al2O3*nH2O
и криолит Na3AlF6. Общим продуктом разрушения пород является каолин, который
состоит в основном из глинистого минерала каолинита Al2O3*2SiO2*2H2O.
Большая часть кальция
встречается в природе в виде месторождений известняка и мела, состоящих в
основном из кальцитового минерала CaCO3 и мрамора. Среди других пород наиболее
распространены доломит CaCO3*MgCO3, ангидрит CaSO4 и гипс CaSO4*2H2O, флюорит
CaF2 и апатит 3Ca3(PO4)2*Ca(F, Cl)2. Кальций в значительных количествах содержится
в различных силикатах, таких как CfO*3MgO*4SiO2 (асбест) и алюмосиликатах.
Магний в природе часто
встречается в виде магнезита MgCO3 и доломита, силиката Mg2SiO4 (оливин),
кайнита KCl*MgSO4*3H2O и карналлита KCl*MgCl2*6H2O. Природными соединениями
щелочных металлов являются NaCl*KCl-Сильвинит, NaCl-Галогенит и
Na2SO4*10H2O-Мирабилит.
Железо — самый
распространенный металл в мире после алюминия. Это компонент многочисленных
минералов, которые образуют скопления железных руд: Гематит Fe2O3, магнетит
Fe3O4, гидрогеетит HFeO2*nH2O, сидерит FeCO3 и другие.
Время от времени встречается
и местное железо метеоритного или земного происхождения.
Многие металлы часто
сопровождают наиболее важные природные минералы: скандий является компонентом
олова, вольфрама и кадмия в качестве примеси в цинковых рудах, ниобия и тантала
в оловянных рудах. Железные руды всегда сопровождаются марганцем, никелем,
кобальтом, молибденом, титаном, германием, ванадием.
Свойства
Строение кристаллической решётки определяет основные физические и химические свойства металлов. Металлы блестят, плавятся, проводят тепло и электричество. Промышленность и металлургия нашли применение физическим свойствам металлов в изготовлении деталей, фольги, корпусов машин, зеркал, бытовой и промышленной химии. Особенности металлов и их использование представлены в таблице физических свойств металлов.
| Свойства | Особенности | Примеры | Применение |
| Металлический блеск | Способность отражать солнечный свет | Наиболее блестящими металлами являются Hg, Ag, Pd | Изготовление зеркал |
| Плотность | Лёгкие – имеют плотность меньше 5 г/см3 | Na, K, Ba, Mg, Al. Самый лёгкий металл – литий с плотностью 0,533 г/см3 | Изготовление облицовки, деталей самолётов |
| Тяжёлые – имеют плотность больше 5 г/см3 | Sn, Fe, Zn, Au, Pb, Hg. Самый тяжёлый – осмий с плотностью 22,5 г/см3 | Использование в сплавах | |
| Пластичность | Способность изменять форму без разрушений (можно раскатать в тонкую фольгу) | Наиболее пластичные – Au, Cu, Ag. Хрупкие – Zn, Sn, Bi, Mn | Формовка, сгибание труб, изготовление проволоки |
| Твёрдость | Мягкие – режутся ножом | Na, K, In | Изготовление мыла, стекла, удобрений |
| Твёрдые – сравнимы по твёрдости с алмазом | Самый твёрдый – хром, режет стекло | Изготовление несущих конструкций | |
| Температура плавления | Легкоплавкие – температура плавления ниже 1000°С | Hg (38,9°С), Ga (29,78°С), Cs (28,5°С), Zn (419,5°C) | Производство радиотехники, жести |
| Тугоплавкие – температура плавления выше 1000°С | Cr (1890°С), Mo (2620°С), V (1900°С). Наиболее тугоплавкий – вольфрам (3420°С) | Изготовление ламп накаливания | |
| Теплопроводность | Способность передавать тепло другим телам | Лучше всего проводят ток и тепло Ag, Cu, Au, Al | Приготовление пищи в металлической посуде |
| Электропроводность | Способность проводить электрический ток за счёт свободных электронов | Передача электричества по проводам |
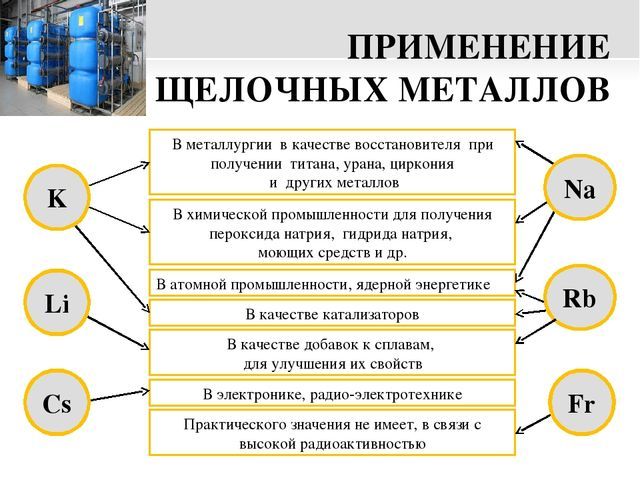
Рис. 3. Примеры применения металлов.
Химические явления. Химическая реакция.
Если при физических явлениях вещества, как правило, лишь изменяют агрегатное состояние, то при химических явлениях происходит превращение одних веществ в другие вещества. Приведем несколько простых примеров: горение спички сопровождается обугливанием древесины и выделением газообразных веществ, то есть, происходит необратимое превращение древесины в другие вещества. Другой пример: со временем бронзовые скульптуры покрываются налетом зеленого цвета. Дело в том, что в состав бронзы входит медь. Этот металл медленно взаимодействует с кислородом, углекислым газом и влагой воздуха, в результате на поверхности скульптуры образуются новые вещества зеленого цвета Химические явления – явления превращений одних веществ в другие Процесс взаимодействия веществ с образованием новых веществ называют химической реакцией. Химические реакции происходят повсеместно вокруг нас. Химические реакции происходят и в нас самих. В нашем организме непрерывно происходят превращения множества веществ, вещества реагируют друг с другом, образуя продукты реакции. Таким образом, в химической реакции всегда есть реагирующие вещества, и вещества, образовавшиеся в результате реакции.
- Химическая реакция – процесс взаимодействия веществ, в результате которого образуются новые вещества с новыми свойствами
- Реагенты – вещества, вступающие в химическую реакцию
- Продукты – вещества, образовавшиеся в результате химической реакции
Химическая реакция изображается в общем виде схемой реакции РЕАГЕНТЫ -> ПРОДУКТЫ
- реагенты – исходные вещества, взятые для проведения реакции;
- продукты – новые вещества, образовавшиеся в результате протекания реакции.
Любые химические явления (реакции) сопровождаются определенными признаками, при помощи которых химические явления можно отличить от физических. К таким признакам можно отнести изменение окраски веществ, выделение газа, образование осадка, выделение тепла, излучение света.
Многие химические реакции сопровождаются выделением энергии в виде тепла и света. Как правило, такими явлениями сопровождаются реакции горения. В реакциях горения на воздухе вещества реагируют с кислородом, содержащимся в воздухе. Так, например, металл магний вспыхивает и горит на воздухе ярким слепящим пламенем. Именно поэтому вспышку магния использовали при создании фотографий в первой половине ХХ века. В некоторых случаях возможно выделение энергии в виде света, но без выделения тепла. Один из видов тихоокеанского планктона способен испускать ярко-голубой свет, хорошо заметный в темноте. Выделение энергии в виде света – результат химической реакции, которая протекает в организмах данного вида планктона.
Итог статьи:
- Существуют две большие группы веществ: вещества природного и искусственного происхождения
- В обычных условиях вещества могут находиться в трех агрегатных состояниях
- Свойства веществ, которые определяют измерениями или визуально при отсутствии превращения одних веществ в другие, называют физическими
- Кристаллы – твердые тела, имеющие форму правильных многогранников
- Аморфные вещества – вещества, не имеющие кристаллического строение
- Химические явления – явления превращений одних веществ в другие
- Реагенты – вещества, вступающие в химическую реакцию
- Продукты – вещества, образующиеся в результате химической реакции
- Химические реакции могут сопровождаться выделением газа, осадка, тепла, света; изменением окраски веществ
- Горение – сложный физико-химический процесс превращения исходных веществ в продукты сгорания в ходе химической реакции, сопровождающийся интенсивным выделением тепла и света (пламени)
Химические и физические свойства
Отдавая в результате химических реакций электрон с внешнего электронного слоя, атомы металлов этой группы проявляют высокую химическую активность. Они являются восстановителями, превращаясь в катионы — положительно заряженные ионы.
В роли окислителей в таких взаимодействиях участвуют простые и сложные вещества. Это могут быть неметаллы, органические соединения, кислоты, соли, оксиды.
- Реакция с кислородом:
Оксид в качестве продукта образовывается только в реакциях лития:
4Li+O2=2Li2O
В случае с натрием в ходе реакции образуется пероксид, а с калием, рубидием, цезием — надпероксид:
2Na+O2=Na2O2
K+O2=KO2
- К реакциям с простыми веществами относится образование галогенидов:
2Na+Cl2=2NaCl
Рассматривая взаимодействие с H2, S, P, C, Si, необходимо знать, что для протекания данных реакций необходимо нагревание.
Литий реагирует с азотом при комнатной температуре.
- Реакции с водой протекают у щелочных металлов по-разному: литий — спокойно, всплывая на поверхность жидкости, натрий реагирует более активно с образованием пламени, калий, цезий и рубидий реагируют со взрывом. В общем виде
2M+2H2O=2MOH+H2 (М – металл)
- В два этапа протекают реакции с кислотами. Металл сначала вступает в реакцию с водой, а после, в момент образования щелочи, она реагирует с разбавленной кислотой и нейтрализуется. Такие реакции часто протекают со взрывом, поэтому на практике проводятся редко.
- В результате реакции с аммиаком образуются амиды:
2Li+2NH3=2LiNH2+H2
- Взаимодействие с этанолом, фенолами, в ходе которого щелочные металлы замещают атомы водорода в гидроксильной группе ОН этих соединений:
2Na+2C2H5OH=2C2H5ONa+H2
- Щелочные металлы могут использоваться для восстановления других металлов, к примеру, алюминия:
3Na+AlCl3=Al+3NaCl
Физические свойства щелочных металлов объясняются металлической связью в кристаллической решетке. Для них характерен металлический блеск, отличная ковкость, пластичность, тепло- и электропроводность.
Самым твердым из всей группы является литий, а самая высокая плотность у цезия. Некоторые физические свойства щелочных металлов в сравнении представлены в следующей таблице:
Из таблицы следует, что все элементы получили свое применение благодаря низким температурам плавления (кипения). Их значения снижаются по мере увеличения порядкового номера в Периодической системе Менделеева.
Все металлы, за исключением лития, настолько мягки, что их можно разрезать ножом или на специальном оборудовании раскатать в лист фольги.
Еще одно свойство, которое имеет практическое значение в промышленности — низкая плотность. Плотность лития, натрия и калия ниже плотности воды.
Указанные физические свойства обусловлены слабой связью электронов внешних слоев с атомами щелочных металлов. Поэтому энергия ионизации атомов невысокая, и они при взаимодействии друг с другом образуют металлическую связь.
В периодической таблице в начале каждого периода стоит элемент с низкой температурой плавления (щелочной металл). По мере увеличения порядковых номеров в периоде слева направо этот показатель сначала увеличивается к середине периода (IV А группа), где расположены элементы, образующие преимущественно атомные кристаллические решетки (C, Si).
Затем в конце периода температуры плавления снова уменьшаются, поскольку в VII-VIII группах расположены элементы, простые вещества которых характеризуются молекулярными кристаллическими решетками (галогены, благородные газы).
ПРОИСХОЖДЕНИЕ

Самородное железо
Происхождение теллурическое (земное) железо редко встречается в базальтовыхлавах (Уифак, о. Диско, у западного берега Гренландии, вблизи г. Касселя Германия). В обоих пунктах с ним ассоциируют пирротин (Fe1-xS) и когенит (Fe3C), что объясняют как восстановление углеродом (в том числе и из вмещающих пород), так и распадом карбонильных комплексов типа Fe(CO)n. В микроскопических зернах оно не раз устанавливалось в измененных (серпентинизированных) ультраосновных породах также в парагенезисе с пирротином, иногда с магнетитом, за счет которых оно и возникает при восстановительных реакциях. Очень редко встречается в зоне окисления рудных месторождений, при образовании болотных руд. Зарегистрированы находки в осадочных породах, связываемые с восстановлением соединений железа водородом и углеводородами.
Почти чистое железо найдено в лунном грунте, что связывают как с падениями метеоритов, так и с магматическими процессами. Наконец, два класса метеоритов – железокаменные и железные содержат природные сплавы железа в качестве породообразующего компонента.
Химические свойства металлов
Металлы легко отдают электроны, т. е. являются восстановителями. Поэтому они легко реагируют с окислителями.
Вопросы
- Какие атомы являются окислителями?
- Как называются простые вещества, состоящие из атомов, которые способны принимать электроны?
Таким образом, металлы реагируют с неметаллами. В таких реакциях неметаллы, принимая электроны, приобретают обычно НИЗШУЮ степень окисления.
Рассмотрим пример. Пусть алюминий реагирует с серой:
Вопрос. Какой из этих химических элементов способен только отдавать электроны? Сколько электронов?
Алюминий — металл, имеющий на внешнем уровне 3 электрона (III группа!), поэтому он отдаёт 3 электрона:
Поскольку атом алюминия отдает электроны, атом серы принимает их.
Вопрос. Сколько электронов может принять атом серы до завершения внешнего уровня? Почему?
У атома серы на внешнем уровне 6 электронов (VI группа!), следовательно, этот атом принимает 2 электрона:
Таким образом, полученное соединение имеет состав:
В результате получаем уравнение реакции:
Задание 8.5. Составьте, рассуждая аналогично, уравнения реакций:
- кальций + хлор (Cl2);
- магний + азот (N2).
Составляя уравнения реакций, помните, что атом металла отдаёт все внешние электроны, а атом неметалла принимает столько электронов, сколько их не хватает до восьми.
Названия полученных в таких реакциях соединений всегда содержат суффикс ИД:
Корень слова в названии происходит от латинского названия неметалла (см. урок 2.4).
Металлы реагируют с растворами кислот (см. урок 2.2). При составлении уравнений подобных реакций и при определении возможности такой реакции следует пользоваться рядом напряжений (рядом активности) металлов:
![]()
Металлы, стоящие в этом ряду до водорода, способны вытеснять водород из растворов кислот:
Задание 8.6. Составьте уравнения возможных реакций:
- магний + серная кислота;
- никель + соляная кислота;
- ртуть + соляная кислота.
Все эти металлы в полученных соединениях двухвалентны.
Реакция металла с кислотой возможна, если в результате её получается растворимая соль. Например, магний практически не реагирует с фосфорной кислотой, поскольку его поверхность быстро покрывается слоем нерастворимого фосфата:
Металлы, стоящие после водорода, могут реагировать с некоторыми кислотами, но водород в этих реакциях не выделяется:
![]()
Задание 8.7. Какой из металлов — Ва, Mg, Fе, Рb, Сu — может реагировать с раствором серной кислоты? Почему? Составьте уравнения возможных реакций.
Металлы реагируют с водой, если они активнее железа (железо также может реагировать с водой). При этом очень активные металлы (Li – Al) реагируют с водой при нормальных условиях или при небольшом нагревании по схеме:
где х — валентность металла.
Задание 8.8. Составьте уравнения реакций по этой схеме для К, Nа, Са. Какие ещё металлы могут реагировать с водой подобным образом?
Возникает вопрос: почему алюминий практически не реагирует с водой? Действительно, мы кипятим воду в алюминиевой посуде, — и… ничего! Дело, в том, что поверхность алюминия защищена оксидной пленкой (условно — Al2O3). Если её разрушить, то начнётся реакция алюминия с водой, причём довольно активная. Полезно знать, что эту плёнку разрушают ионы хлора Cl–. А поскольку ионы алюминия небезопасны для здоровья, следует выполнять правило: в алюминиевой посуде нельзя хранить сильно солёные продукты!
Вопрос. Можно ли хранить в алюминиевой посуде кислые щи, компот?
Менее активные металлы, которые стоят в ряду напряжений после алюминия, реагируют с водой в сильно измельчённом состоянии и при сильном нагревании (выше 100 °C) по схеме:
Металлы, менее активные, чем железо, с водой не реагируют!
Металлы реагируют с растворами солей. При этом более активные металлы вытесняют менее активный металл из раствора его соли:

Задание 8.9. Какие из следующих реакций возможны и почему:
- серебро + нитрат меди II;
- никель + нитрат свинца II;
- медь + нитрат ртути II;
- цинк + нитрат никеля II.
Составьте уравнения возможных реакций. Для невозможных поясните, почему они невозможны.
Следует отметить (!), что очень активные металлы, которые при нормальных условиях реагируют с водой, не вытесняют другие металлы из растворов их солей, поскольку они реагируют с водой, а не с солью:
А затем полученная щёлочь реагирует с солью:
![]()
Поэтому реакция между сульфатом железа и натрием НЕ сопровождается вытеснением менее активного металла:
![]()
Микроскопическая структура
Характерные свойства металлов
можно понять исходя из их внутренней структуры. Все они имеют слабую связь
электронов внешнего энергетического уровня (другими словами, валентных
электронов) с ядром. Результирующая разница потенциалов в проводнике приводит к
лавинообразному движению электронов (так называемых электронов проводимости) в
кристаллической решетке. Сочетание этих электронов часто называют электронным
газом. В дополнение к электронам, фононы (колебания решетки) способствуют
теплопроводности. Пластичность обусловлена небольшим энергетическим барьером
для движения дислокаций и смещением кристаллографических плоскостей. Твердость
может быть объяснена большим количеством структурных дефектов (межузловые
атомы, вакансии и т.д.).
Благодаря небольшой отдаче
электронов возможно окисление металла, что может привести к коррозии и
дальнейшему ухудшению свойств. Способность металлов к окислению можно узнать из
стандартного диапазона активности металлов. Этот факт подтверждает
необходимость использования металлов в сочетании с другими элементами (сплав,
важнейшим элементом которого является сталь), их сплавов и использования
различных покрытий.
Для более корректного
описания электронных свойств металлов следует использовать квантовую механику.
Во всех твердых телах с достаточной симметрией энергетические уровни электронов
отдельных атомов перекрываются и образуют разрешенные зоны, а зону,
образованную валентными электронами, называют валентной зоной. Слабая связь
валентных электронов в металлах приводит к тому, что валентная зона в металлах
очень широка и не все валентные электроны достаточны для ее полного заполнения.
Главной характеристикой такой
частично заполненной зоны является то, что даже при минимальном приложенном
напряжении в образце начинается реконструкция валентных электронов, т.е.
протекающего электрического тока.
Такая же высокая подвижность
электронов приводит к высокой теплопроводности и способности отражать
электромагнитное излучение (что придает металлам характерный блеск).
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
-
оксид образует только литий
4Li + O2 = 2Li2O
-
натрий образует пероксид
2Na + O2 = Na2O2
-
калий, рубидий и цезий — надпероксид
K + O2 = KO2
Остальные металлы с кислородом образуют оксиды:
2Mg + O2 = 2MgO
2Al + O2 = Al2O3
2Zn + O2 = 2ZnO (при нагревании)
4Cr + 3O2 = 2Cr2O3
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
4Fe + 3O2 (воздух) + 6H2O(влага) = 4Fe(OH)3
С галогенами металлы образуют галогениды:
2Na + Cl2 = 2NaCl
Mg + Cl2 = MgCl2
2Al + 3Br2 = 2AlBr3
Zn + Cl2 =ZnCl2
2Cr + 3Cl2 = 2CrCl3
Медный порошок реагирует с хлором и бромом (в эфире):
Cu + Cl2 = CuCl2
Cu + Br2 = CuBr2
При взаимодействии с водородом образуются гидриды:
2Na + H2 = 2NaH
Ca + H2 +СaH2
Zn + H2 =ZnH2
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
2K + S = K2S
Сa + S = CaS
2Al + 3S = Al2S3
2Cr + 3S = Cr2S3
Cu +S = CuS
Реакции с фосфором протекают до образования фосфидов (при нагревании):
3K + P = K3P
3Mg + 2P = Mg3P2
3Zn + 2P = Zn3P2
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
2Li + 2C = Li2C2
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
Ca + 2C = CaC2
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
6Li + N2 = 2Li3N
3Mg + N2 = Mg3N2
2Al + N2 = 2AlN
2Cr + N2 = 2CrN
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
2Li + 2H2O = 2LiOH + H2
Ca + 2H2O = Ca(OH)2 + H2
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Cr + H2O = Cr2O3 + H2
Zn + H2O = ZnO + H2
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.


Металлы IА группы:
2K + H2SO4 (раствор) = K2SO4 + H2
8K + 5H2SO4 (конц) = 4K2SO4 + H2S + 4H2O
8Na + 10HNO3 (раствор) = 8NaNO3 + NH4NO3 + 3H2O
3Na + 4HNO3 (конц) = 3NaNO3 + NO + 2H2О
Металлы IIА группы
Mg + H2SO4 (раствор) = MgSO4 + H2
4Mg + 5H2SO4 (конц) = 4MgSO4 + H2S + 4H2O
Mg+ 4HNO3 (конц) = Mg(NO3)2 + 2NO2 + 2H2O
4Mg + 10HNO3 (раствор) = 4Mg(NO3)2 + 2N2O + 5H2O
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
2Li + 2NH3 = 2LiNH2 + H2
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C2H5OH = 2C2H5ONa + H2
2K + 2C6H5OH = 2C6H5OK + H2
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
8Al + 3Fe3O4 = 4Al2O3 + 9Fe (алюмотермия)
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
ПРИМЕНЕНИЕ

Кольцо из железа
Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства.
Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.
Железо может входить в состав сплавов на основе других металлов — например, никелевых.
Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
Ультрадисперсный порошок магнетита используется во многих чёрно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера. Здесь одновременно используется чёрный цвет магнетита и его способность прилипать к намагниченному валику переноса.
Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат.
Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
Железо (англ. Iron) – Fe
| Молекулярный вес | 55.85 г/моль |
| Происхождение названия | возможно англо-саксонского происхождения |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |


































