Презентация на тему: » АЛКАНЫ Строение молекулы метана. Свойства метана и его гомологов.» — Транскрипт:
1
АЛКАНЫ Строение молекулы метана. Свойства метана и его гомологов.

2
Цели урока Рассмотреть строение молекул метана и его гомологов. Изучить физические свойства алканов. Ознакомиться с изомерией и номенклатурой алканов.

3
Вспомните, какие вещества мы называем углеводородами? УГЛЕВОДОРОДЫ – это органические соединения, состоящие из двух химических элементов – УГЛЕРОДА И ВОДОРОДА.

4
АЛКАНЫ (предельные, насыщенные, парафины) – это углеводороды с общей формулой C n H 2n+2, которые не способны на реакции присоединения.
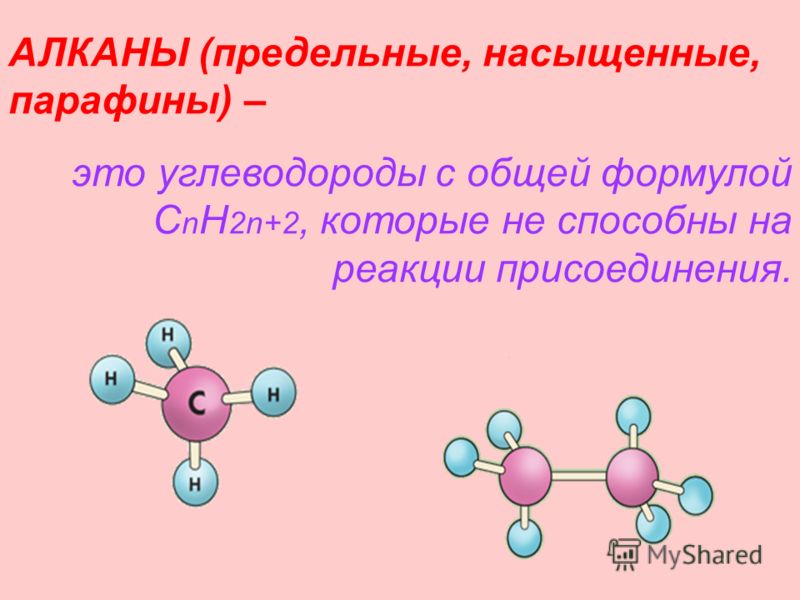
5
АЛКАНЫ название предельных углеводородов по международной номенклатуре (ИЮПАК). ПАРАФИНЫ исторически сохранившееся название предельных углеводородов (от лат. parrum affinis – малоактивный).

6
Строение молекулы метана Молекулярная формула молекулы метана CH 4 Пространственное строение молекулы метана
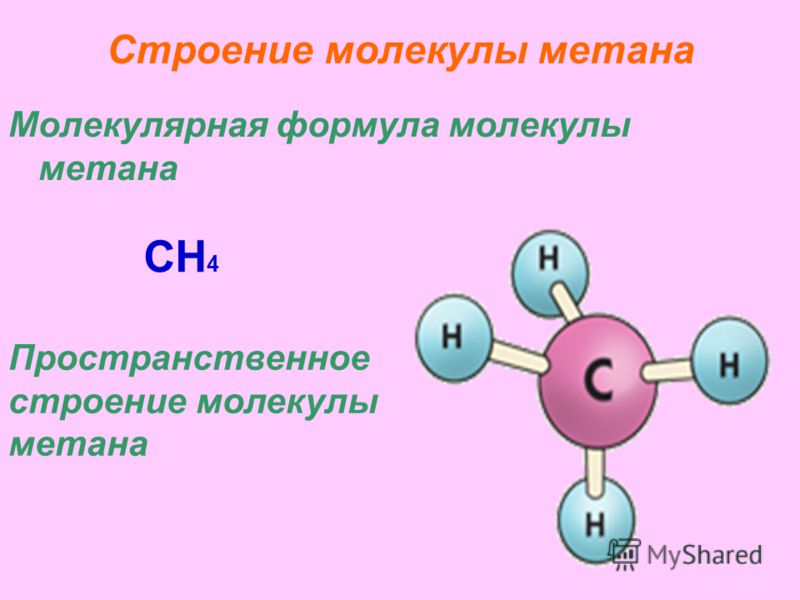
7
Какие химические связи в молекуле метана? Какой вид гибридизации атомов углерода будет осуществляться в молекулах алканов? КПС, одинарные, равные по характеристикам sp 3 — гибридизация
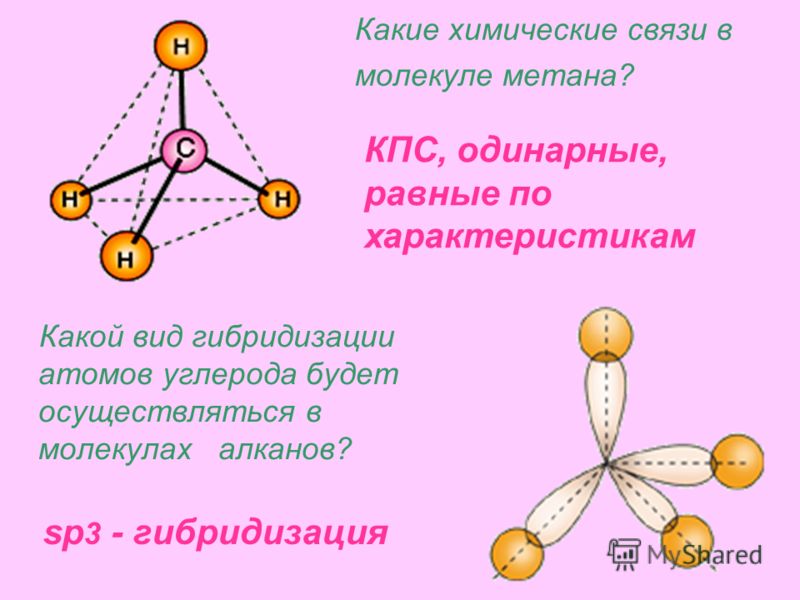
8
Длина простой химической связи 1,54 Å (ангстрема), угол HCH 109°28` В предельных углеводородах атом углерода находится в состоянии sp3-гибридизации. Молекула метана представляет собой тетраэдр с атомом углерода в центре и атомами водорода по вершинам тетраэдра.
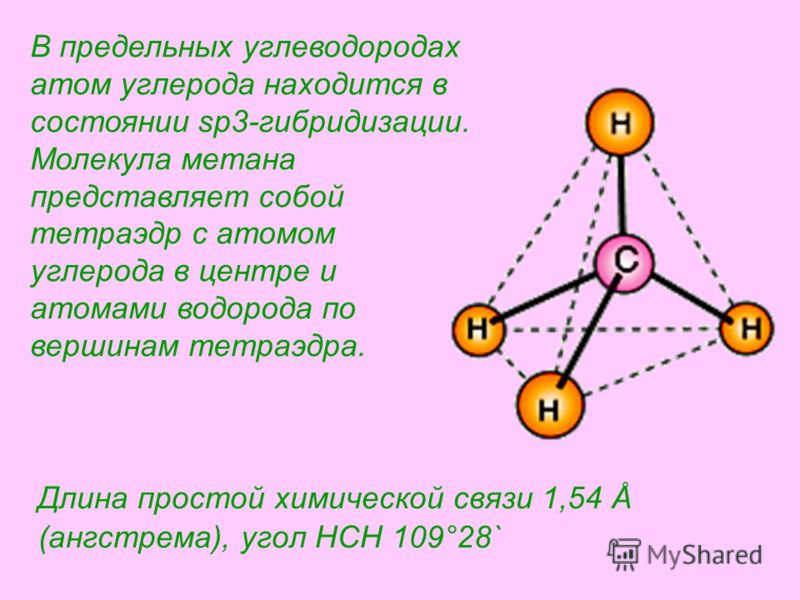
9
ГОМОЛОГИЧЕСКИЙ РЯД АЛКАНОВ Вспомните, какие вещества мы называем гомологами? ГОМОЛОГИ – это вещества со схожими строением и свойствами, но различающиеся по составу на одну или несколько групп CH 2 (гомологическая разность).

10
СН 4 -С 4 Н 10 С 5 Н 12 -С 15 Н 32 С 16 Н 34 -… твердые

11
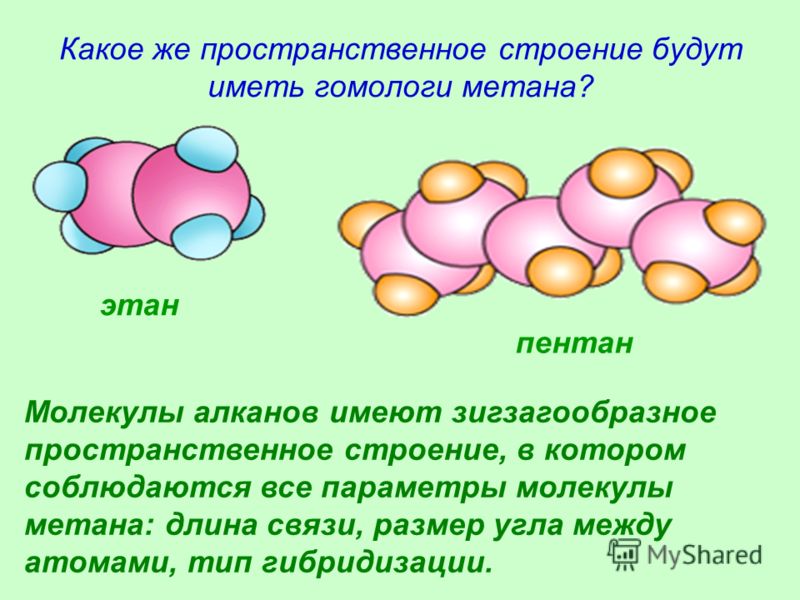
Какое же пространственное строение будут иметь гомологи метана? этан пентан Молекулы алканов имеют зигзагообразное пространственное строение, в котором соблюдаются все параметры молекулы метана: длина связи, размер угла между атомами, тип гибридизации.
12
ФИЗИЧЕСКИЕ СВОЙСТВА АЛКАНОВ. НАХОЖДЕНИЕ В ПРИРОДЕ. МЕТАН – газ, без цвета и запаха, почти в 2 раза легче воздуха, мало растворим в воде. Он образуется в природе в результате разложения без доступа воздуха остатков растительных и животных организмов. Поэтому может быть обнаружен в заболоченных водоемах, где появляется в виде пузырьков газа, или накапливается в каменноугольных шахтах, куда выделяется из угольных пластов. В значительном количестве (80-97%) метан содержится в природном газе и в попутных нефтяных газах.

13
ЭТАН, ПРОПАН И БУТАН входят в состав природного и попутного нефтяного газов. АЛКАНЫ содержатся в нефти. С ростом относительной молекулярной массы наблюдается переход количественных отношений в качественные: изменяется агрегатное состояние, возрастают температуры плавления и кипения.

14
ИЗОМЕРИЯ И НОМЕНКЛАТУРА АЛКАНОВ У алканов наблюдается изомерия углеродного скелета. Чтобы составить название углеводорода с разветвленной цепью, его рассматривают как продукт замещения атомов водорода в нормальном углеводороде углеводородными радикалами. 1. Выделяют в структурной формуле наиболее длинную цепь атомов углерода и нумеруют эти атомы, начиная с того к которому ближе разветвление СН 3 — СН — СН 2 — СН 2 — СН 3 СН СН 3 – СН – СН – СН 3 СН 3 СН 3

15
2. Когда радикалов несколько и они равноудалены от концов главной цепи, то нумерацию начинают с того края, к которому ближе расположен простейший радикал. 3. В названии вещества цифрой указывают, при каком атоме углерода находится радикал и называют его (начиная с простейшего). Если радикалы повторяются, то номер повторяют по числу этого радикала, а перед названием радикала приписывают приставку от греческого числительного («ди»-2, «три»-3, «тетра»-4 и т.д.) а) 2 — метил…б) 2,3 – диметил…

16
а) 2 – метилпентан 5. Завершают название алкана по числу атомов углерода в нумерованной цепи. 4. Если радикалов несколько, то цифрами указывают каждого из них. б) 2,3 — диметилбутан

17
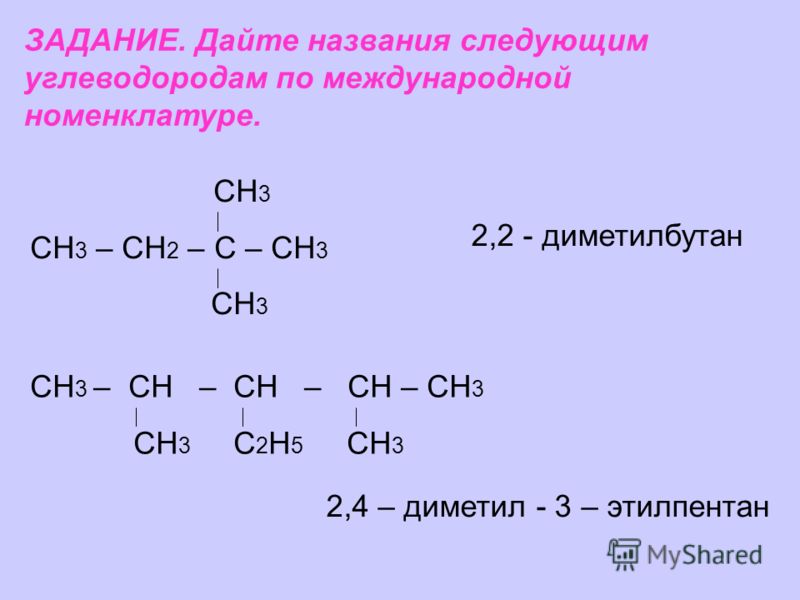
ЗАДАНИЕ. Дайте названия следующим углеводородам по международной номенклатуре. СН 3 СН 3 – СН 2 – С – СН 3 СН 3 2,2 — диметилбутан СН 3 – СН – СН – СН – СН 3 СН 3 С 2 Н 5 СН 3 2,4 – диметил — 3 – этилпентан
18
ДОМАШНЕЕ ЗАДАНИЕ: 1.учить конспект, 2. §33.1, вопросы 1,6 (устно); 15* (письменно)
Добыча исходных компонентов и хранение смеси
Пропан – побочный продукт добычи и переработки нефти. Такое происходит, например при фрекинге, добычи нефти с гидроразрывом пласта, а также при переработке добытого жидкого углеводорода на НПЗ. Бутан несколькими химическими способами: реакция Вюрца, гидрирование алкинов и в несколько этапов из спиртов.
Смесь пропан-бутан хорошо хранится в газгольдерах в сжиженном виде. Сам процесс превращения в жидкость происходит под высоким давлением, которое потом поддерживается в ёмкостях, где находится СУГ. Хранится топливо в обычных температурных условиях, поэтому часть вещества внутри баллонов переходит в газообразное состояние.
Общее понятие о строении метана
Определяющая метан формула имеет вид , то есть молекула его образована одним атомом углерода с валентностью IV и четырьмя водородными атомами. На понимании того, как строится эта молекула, основано дальнейшее изучение всех органических соединений.
Электроны в атоме углерода
В основном состоянии углерод характеризуется конфигурацией электронного облака и валентностью II, поскольку обладает лишь двумя неспаренными внешними электронами:
При сообщении некоторой энергии происходит возбуждение атома, 2s2-электроны распариваются и один из них занимает вакантную орбиталь на 2p-подуровне. В результате атом получает четыре неспаренных электрона и валентность IV:
Углерод во всех органических соединениях четырехвалентен.
Подуровни 2s и 2p стремятся к выравниванию энергий своих электронов, что ведет к перераспределению электронных плотностей их облаков и к изменению их формы. Образуются гибридные 2sp-облака (орбитали). Их количество зависит от того, сколько орбиталей участвует в гибридизации.
Если в нее вступают наряду с 2s все три 2p-орбитали, говорят о гибридизации типа sp3. В этом случае образуются четыре одинаковых гибридных электронных облака. Оси их вследствие взаимного отталкивания располагаются в пространстве таким образом, что атом приобретает форму тетраэдра. Молекулы метана и прочих алканов образованы только sp3-гибридизованным углеродом.
Молекула метана
Углеродный атом в sp3-гибридизованном состоянии вступает в четыре равноправных ковалентных простых σ-связи с водородом. Каждая из них формируется путем перекрывания одной из четырех углеродных 2sp3-орбиталей с 1s1-орбиталью водорода по линии, проходящей через ядра атомов. Ориентация σ-связей соответствует осям гибридных орбиталей, поэтому молекула имеет тетраэдрическую форму.
Строение молекулы удобно отображать с помощью структурной и электронной формул:
В молекулах метана и его гомологов углерод связывается с наибольшим возможным числом атомов водорода, поэтому углеводороды ряда алканов называют предельными.
Вред и польза метана
Вследствие малой растворимости и слабой химической активности метан нетоксичен, однако длительное пребывание в среде с повышенной концентрацией газа негативно отражается на нервной системе. Если содержание его в воздухе превышает 25%, человек может пострадать от кислородного голодания.
Как сильный парниковый газ, метан оказывает влияние на климат. Несмотря на малую концентрацию в атмосфере, по вкладу в парниковый эффект он занимает третье место после водяного пара и углекислого газа. Парниковое действие метана приблизительно в 25 раз превышает эффект, оказываемый тем же молярным объемом углекислого газа.
Метан обладает полезными свойствами. При полном сгорании он не образует твердых продуктов, загрязняющих внутренние части оборудования и окружающую среду. В сочетании с дешевизной это качество расширяет перспективы использования метана как экономичного и чистого топлива.
Основные источники на Земле
Существует несколько основных источников CH4 на нашей планете
Среди них важное значение имеют следующие:

- Углеводородное горючее. Добыча нефти и природного газа приводит к постоянной утечке метана. В процессе любых манипуляций с бензином, дизельным топливом и другими продуктами перегонки нефти происходит выделение рассматриваемого газа.
- В процессе кислородного горения биомассы (пожары в тропических лесах и саванне).
- Животноводство. Оно является одним из главных источников выделения метана, которое обусловлено деятельностью человека. Во-первых, в процессе переваривания растительной пищи в пищеварительной системе крупного и мелкого рогатого скота происходит так называемый процесс ферментации, сопровождаемый образованием большого количества CH4. Во-вторых, экскременты животных в процессе бескислородного разложения также приводят к освобождению метана. В некоторых хозяйствах этот способ используется для его получения в качестве последующего применения как источника энергии.
- Болота. Это еще один источник природного газа, который образуется в результате гниения органики. Некоторые ученые считают, что с момента появления агрокультуры и возделывания человеком земли увеличилось количество метана в атмосфере. Связано это с тем, что люди начали менять русла рек, строить плотины и каналы с целью полива и орошения своих посевов. Эта антропогенная деятельность активировала процессы бескислородного гниения органических соединений.
- Любые органические выбросы, связанные с деятельностью человека. Остатки пищи, бумага, листья, корм для скота — все эти вещества в процессе своего анаэробного разложения выделяют большие количества метана.
Формула метана и способы его получения
| Молекулярная формула метана | Структурная формула метана |
| Канал 4 | ЧАС
| Н — Д — Н | ЧАС |
Метан содержится в больших количествах в атмосфере. На присутствие этого газа в воздухе мы не обращаем внимания, потому что он никак не влияет на наш организм, а вот канарейки очень чувствительны к метану.
Однажды они даже помогли шахтерам уйти под землю. Когда процентное содержание метана изменилось, птицы перестали петь. Это служило сигналом человеку, что он опустился слишком низко и ему нужно подняться.

Метан образуется в результате разложения остатков живых организмов. Не случайно метан переводится с английского как болотный газ, ведь его можно найти в болотистых отложениях и угольных шахтах.
Основным источником газа в агропромышленном комплексе является крупный рогатый скот. Да, они выводят метан из организма вместе с другими продуктами жизнедеятельности. Кстати, увеличение поголовья скота на планете может привести к разрушению озонового слоя, ведь метан и кислород образуют взрывоопасную смесь.
Метан в промышленности можно получить при нагревании угля и водорода или путем синтеза водяного газа, все реакции проводят в присутствии катализатора, чаще всего никеля.
В США разработана целая система добычи метана, она способна извлекать до 80% газа из природного угля. На сегодняшний день мировые запасы метана эксперты оценивают в 260 триллионов кубометров! Даже запасы природного газа намного меньше.
В лаборатории метан получают путем взаимодействия карбида алюминия (неорганического соединения алюминия с углеродом) и воды. Также с помощью гидроксида натрия, вступающего в реакцию с ацетатом натрия, более известного как пищевая добавка Е262.
Формула метана и способы его получения
| Молекулярная формула метана | Структурная формула метана |
| СH4 | Н |
Н — С — Н | Н |
Метан в больших количествах содержится в атмосфере. Мы не обращаем внимания на нахождение этого газа в воздухе, ведь на нашем организме это никак не отражается, а вот канарейки очень чувствительны к метану.
Когда-то они даже помогали шахтерам спускаться под землю. Когда процентное содержание метана изменялась, птицы переставали петь. Это служило сигналом для человека, что он спустился слишком глубоко и нужно подниматься наверх.

Образуется метан в результате распада остатков живых организмов. Не случайно с английского methane переводится, как болотный газ, ведь он может быть обнаружен в заболоченных водоемах и каменноугольных шахтах.
Основным источником газа в агропромышленном комплексе является рогатый скот. Да, метан они выводят из организма вместе с остальными продуктами жизнедеятельности. Кстати, увеличение числа рогатого скота на планете может привести к разрушению озонового слоя, ведь метан с кислородом образуют взрывоопасную смесь.
Метан в промышленности можно получить с помощью нагревания углерода и водорода или синтеза водяного газа, все реакции протекают в присутствии катализатора, чаще всего никеля.
В США разработана целая система по добыче метана, она способна извлечь до 80% газа из природного угля. На сегодняшний день мировые запасы метана оцениваются экспертами в 260 триллионов метров кубических! Даже запасы природного газа значительно меньше.
В лаборатории метан получают путем взаимодействия карбида алюминия (неорганическое соединение алюминия с углеродом) и воды. Также с помощью гидроксида натрия, вступающего в реакцию с ацетатом натрия, более известного как пищевая добавка Е262.
Хлорметан — WiKi
Хлормета́н (метилхлори́д) — органическое вещество, принадлежащее к группе галогеналканов. Впервые был получен французскими химиками Жаном Батистом Дюма и Эженом Пелиго в 1835 году кипячением смеси метанола, серной кислоты и хлорида натрия. Аналогичный способ используется и в наши дни. Хлорметан — бесцветный легколетучий ядовитый газ со сладковатым запахом. Из-за слабого запаха можно легко не заметить токсичной или взрывоопасной концентрации.
| Хлорметан | |
|---|---|
| Систематическоенаименование | Хлорметан |
| Традиционные названия | монохлорметан, метилхлорид, фреон 40, R 40, UN 1063 |
| Хим. формула | CH3Cl |
| Рац. формула | CH3Cl |
| Состояние | газ |
| Молярная масса | 50.49 г/моль |
| Плотность | 0.915 г/см³ |
| Энергия ионизации | 11,28 ± 0,01 эВ |
| Т. плав. | −97.7 °C |
| Т. кип. | -24.2 °C |
| Т. всп. | -46 °C |
| Т. свспл. | 625 °C |
| Пр. взрв. | 8,1 ± 0,1 об.% |
| Удельная теплота испарения | 423850 Дж/кг |
| Давление пара | 490 kPa |
| Растворимость в воде | 5.325 г/100 мл |
| Гибридизация | тетраэдр |
| Рег. номер CAS | 74-87-3 |
| PubChem | 6327 |
| Рег. номер EINECS | 200-817-4 |
| SMILES | |
| InChI | |
| RTECS | PA6300000 |
| ChEBI | 36014 |
| Номер ООН | 1063 |
| ChemSpider | 6087 |
| Токсичность | ядовит, огнеопасен, канцероген |
| NFPA 704 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Производство
Большая часть хлорметана получается реакцией метанола с хлороводородом, согласно следующей химической реакции:
-
- Ch4OH+HCl→Ch4Cl+h3O{\displaystyle {\mathsf {CH_{3}OH+HCl\rightarrow CH_{3}Cl+H_{2}O}}}
Это может быть осуществлено пропусканием хлороводорода через кипящий метанол вместе с хлоридом цинка в качестве катализатора или пропусканием смеси метанола и хлороводорода через окись алюминия при 350 °C.
Меньшие количества хлорметана производят нагреванием смеси метана и хлора до 400 °C. Однако этот метод дает смесь с более хлорированными производными метана (дихлорметан, хлороформ, тетрахлорметан) и используется тогда, когда необходимы эти вещества.
Применение
Хлорметан был широкоприменяемым хладагентом. Но такое его применение прекратили из-за токсичности и пожароопасности. Хлорметан был использован для производства добавок к бензину на основе свинца (тетраметилсвинец).
Наиболее важное использование хлорметана сейчас в качестве химического полупродукта в производстве силиконовых полимеров. Меньшие количества используют в качестве растворителя при производстве бутилкаучука и очистке бензина
Хлорметан используют как метилирующий или хлорирующий агент в органической химии. Он находит также множество различных применений: удаления жирных загрязнений, следов смол, как ракетное топливо, для получения пенополистирола. Как локальное обезболивающее, как промежуточный продукт при синтезе лекарств, как носитель в низкотемпературной полимеризации, как жидкость для термометрического и термостатического оборудования, в качестве гербицида.
Безопасность
Вдыхание газообразного хлорметана оказывает токсическое действие на центральную нервную систему. У пострадавшего возникает сонливость, головокружение, рассеянность, нарушение координации движений, спутанность речи, нарушение дыхания, удушье. При больших концентрациях наступают судороги, параличи и кома.
В случае проглатывания может возникнуть тошнота и рвота. Контакт сжиженного метилхлорида с кожей приводит к обморожению. Контакт с глазами может привести к ухудшению зрения.
Хроническое воздействие хлорметана вызывает тератогенный эффект.
Фармакологическое действие [ править | править код ]
Проникая в клеточное ядро, активирует генетический аппарат клетки, что приводит к увеличению синтеза ДНК, РНК и структурных белков, активации ферментов цепи тканевого дыхания и усилению тканевого дыхания, окислительного фосфорилирования, синтеза АТФ и накоплению макроэргов внутри клетки. Стимулирует анаболические и подавляет катаболические процессы, вызванные ГКС. Приводит к увеличению мышечной массы, уменьшению отложений жира и положительному азотистому балансу. Гемопоэтическое действие связано с увеличением синтеза эритропоэтина. Противоаллергическое действие обусловлено повышением концентрации ингибитора C-1 фракции комплемента и снижением содержания C-2 и C-4 фракций комплемента. Наличие андрогенной активности может способствовать развитию вторичных половых признаков по мужскому типу. Длительность действия — до 14 ч.
Причины и симптомы отравления метаном
Существую риски отравления газом. Метан опасен для людей, которые работают в закрытом пространстве – шахты, промышленные строения, где есть риск скопления больших концентраций вещества в помещении, либо люди подвержены систематическому воздействию ядовитого газа.
Хроническая интоксикация организма
- Глазосердечный рефлекс – надавливая на глазные яблоки при закрытых веках количество сокращений сердца резко снижается до 4-8 ударов в минуту. Это связано с угнетением импульсов блуждающего и тройничного нервов. Осложнения симптома – устойчивая брадикардия, нарушение ритмических сердечных сокращений (асистолия).
- Гипотония – стабильное снижение артериального давления, постоянная сонливость, физическая слабость, вялость и разбитость, бледность кожных покровов, одышка, усиливающаяся при движении. На фоне развития гипотонии у пострадавшего случаются обмороки, особенно когда человек находится долгое время в вертикальном положении (в душном транспорте или помещении). Из-за дневной сонливости нарушается качество и продолжительность ночного сна. Днем не ощущает чувства бодрости. Частые симптомы – головокружение, тошнота.
- Атропиновая проба резко выраженная – диагностический метод, который позволяет выявить нарушение работы сердца и других внутренних органов.
Острое отравление метаном
Признаки, характерные для отравления метаном в больших концентрациях, отличаются выраженностью. Первоначально человек испытывает удушье. Появляется одышка из-за недостатка кислорода, нарушается кровообращение. Постепенно симптом нарастает. Это может вызвать у человека приступ паники или страха. Пострадавший принимает вынужденное положение тела – наклонен вперед, опираясь на колени. Характеристика дыхания:
- шумное;
- частое;
- иногда со свистом;
- выдох происходит тяжелее, чем вдох.
Затем присоединяется кашель, может быть усиленная секреция слизистой бронхов. Поэтому иногда наблюдается обильное отхождение мокроты. Пульс становится частым, нагрузка на сердце увеличивается. Из-за ложного чувства нехватки воздуха человек делает глубокие вдохи.
На фоне общей интоксикации и поражения центральной нервной системы действие метана на организм человека проявляется в нарушении координации движений. Особенно страдает мелкая моторика. Признаки отравления головного мозга:

- эйфория сменяются сильными головными болями, нарушением цикличности дыхания;
- отсутствие сна, пострадавший засыпает с трудом;
- потеря аппетита, постоянная тошнота, иногда рвота;
- нарушения деятельности органов чувств;
- симптомы обезвоживания организма – сухость во рту, нарушение водно-солевого баланса.
В тяжелых случаях, которые фиксируются редко (у пожилых, людей с ослабленным здоровьем или хроническими болезнями) наблюдается сильная боль в висках и затылке, язык обложен налетом, развивается сухой кашель. Возникает рвота после каждого приема пищи. Нарушается функциональность ЖКТ – боли в эпигастральной области, понос, диспепсия и другие кишечные расстройства. Кожа становится бледной с синим оттенком. Повышается температура тела на 1-2°, вызывая ломоту в костях и озноб.
В самых тяжелых случаях развивается отек легких.
Откуда берется метан и почему он опасен?
В 2018 году на метан (CH4) приходилось около 9,5% всех выбросов парниковых газов в США в результате деятельности человека. Деятельность человека в вопросе выбросов метана включает утечки из систем добычи природного газа и животноводства. Метан также выделяется из природных источников, таких как естественные водно-болотные угодья. Кроме того, естественные процессы в почве и химические реакции в атмосфере способствуют удалению CH4 из атмосферы. Метан имеет гораздо более короткое время жизни в атмосфере, чем углекислый газ (CO2), но CH4 более эффективно улавливает радиацию. Сравнительное воздействие CH4 в 25 раз больше, чем CO2 за 100-летний период.
Во всем мире 50-65% общих выбросов CH4 приходится на деятельность человека.
- Сельское хозяйство. Крупный рогатый скот, свиньи, овцы и козы производят метан как часть нормального процесса пищеварения. Кроме того, этот газ образуется при хранении или переработке навоза. Поскольку люди разводят этих животных для еды и других продуктов, считается, что выбросы связаны с деятельностью человека. Если объединить выбросы скота и навоза, сельскохозяйственный сектор является крупнейшим источником выбросов метана.
- Энергетика и промышленность. Нефтяные и газовые системы являются вторым по величине источником выбросов метана. Этот газ является основным компонентом природного газа в США. Метан выбрасывается в атмосферу при добыче, переработке, хранении, транспортировке и распределении природного газа, а также при добыче, переработке, транспортировке и хранении сырой нефти. Добыча угля также является источником выбросов CH4.
- Бытовые и коммерческие отходы. Метан образуется на свалках в результате разложения отходов и очистки сточных вод. Свалки являются третьим по величине источником выбросов CH4 в США. Метан также образуется при очистке и компостировании бытовых и промышленных сточных вод.
Метан также выделяется из ряда природных источников. Естественные водно-болотные угодья являются крупнейшим источником выбросов CH4 от бактерий, которые разлагают органические материалы в отсутствие кислорода. Меньшие источники включают термиты, океаны, отложения, вулканы и лесные пожары.
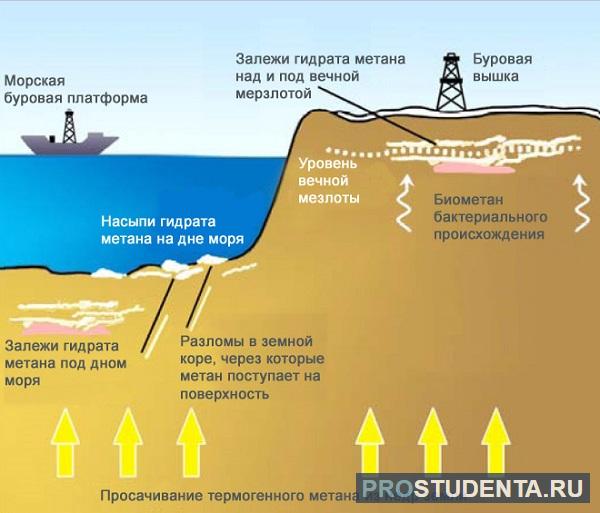
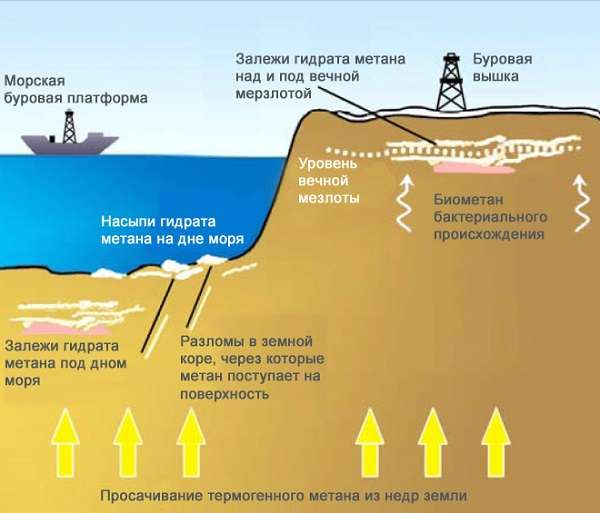
Метан в природе
В природных условиях метан имеет несколько источников:
- природный газ и попутные нефтяные газы, в которых метан является основным компонентом;
- шахтный газ, поступающий из угольных пластов и образующий с воздухом взрывоопасную смесь;
- вулканические газы;
- продукты метаболизма некоторых анаэробных микроорганизмов, перерабатывающих клетчатку и обитающих в болотах, стоячих водоемах, в пищеварительном тракте жвачных животных.
Метан может накапливаться в больших количествах в виде гидрата газа в вечной мерзлоте и на дне океана. В составе гидрата метана молекула внедряется в полости внутри кристаллической решетки водяного льда. Соединения с такой структурой называются клатратами. По мере таяния льда газ выделяется и выбрасывается в атмосферу.
За пределами Земли метан содержится в больших количествах на Титане, спутнике Сатурна, в атмосферах планет-гигантов и на Марсе.
Метан и парниковый эффект
Метан является парниковым газом. Если степень воздействия углекислого газа на климат условно принять за единицу, то парниковая активность метана составит 23 единицы. Содержание метана в атмосфере очень быстро росло за последние два столетия.
Сейчас среднее содержание метана CH4 в современной атмосфере оценивается в 1,8 ppm (частей на миллион, частей на миллион). И, хотя это в 200 раз меньше содержания в нем углекислого газа (СО2), приходящегося на молекулу газа, парниковый эффект метана, то есть его вклад в рассеивание и удержание тепла, излучаемого нагретой солнцем Землей, значительно выше, чем СО2. Кроме того, метан поглощает земное излучение в тех «окнах» спектра, которые прозрачны для других парниковых газов. Без парниковых газов — CO2, водяного пара, метана и некоторых других примесей средняя температура на поверхности Земли была бы всего -23°C, а сейчас составляет около +15°C.
Метан просачивается на дно океана через трещины в земной коре и выделяется в значительных количествах при добыче полезных ископаемых и при сжигании лесов. Недавно был обнаружен совершенно неожиданный новый источник метана — высшие растения, но механизмы образования и значение этого процесса для самих растений до сих пор не выяснены.
.
Применение метана
Метан — наиболее термически устойчивый насыщенный углеводород. Его широко используют как бытовое и промышленное топливо и как сырьё для промышленности. Так, хлорированием метана производят метилхлорид, метиленхлорид, хлороформ, четырёххлористый углерод.
При неполном сгорании метана получают сажу, при каталитическом окислении — формальдегид, при взаимодействии с серой — сероуглерод.
Термоокислительный крекинг и электрокрекинг метана— важные промышленные методы получения ацетилена.
Каталитическое окисление смеси метана с аммиаком лежит в основе промышленного производства синильной кислоты. Метан используют как источник водорода в производстве аммиака, а также для получения водяного газа (т. н. синтез-газа): CH4 + H2O → CO + 3H2, применяемого для промышленного синтеза углеводородов, спиртов, альдегидов и др
Важное производное метана — нитрометан
Автомобильное топливо
Метан широко используется в качестве моторного топлива для автомобилей. Однако плотность природного метана в тысячу раз ниже плотности бензина. Поэтому, если заправлять автомобиль метаном при атмосферном давлении, то для равного с бензином количества топлива понадобится бак в 1000 раз больше. Чтобы не возить огромный прицеп с топливом, необходимо увеличить плотность газа. Это можно достичь сжатием метана до 20–25 МПа (200–250 атмосфер). Для хранения газа в таком состоянии используются специальные баллоны, которые устанавливаются на автомобилях.
Метан и парниковый эффект
Метан является парниковым газом. Если степень воздействия углекислого газа на климат условно принять за единицу, то парниковая активность метана составит 23 единицы. Содержание в атмосфере метана росло очень быстро на протяжении последних двух столетий.
Сейчас среднее содержание метана CH4 в современной атмосфере оценивается как 1,8 ppm (parts per million, частей на миллион). И, хотя это в 200 раз меньше, чем содержание в ней углекислого газа (CO2), в расчете на одну молекулу газа парниковый эффект от метана — то есть его вклад в рассеивание и удержание тепла, излучаемого нагретой солнцем Землей — существенно выше, чем от СО2. Кроме того, метан поглощает излучение Земли в тех «окошках» спектра, которые оказываются прозрачными для других парниковых газов. Без парниковых газов — СO2, паров воды, метана и некоторых других примесей средняя температура на поверхности Земли была бы всего –23°C , а сейчас она около +15°C.
Метан высачивается на дне океана через трещины земной коры, выделяется в немалом количестве при горных разработках и при сжигании лесов. Недавно обнаружен новый, совершенно неожиданный источник метана — высшие растения, но механизмы образования и значение данного процесса для самих растений пока не выяснены.


































