Индивидуальные доказательства
- ^ Г. П. Мосс: Основная терминология стереохимии (Рекомендации ИЮПАК 1996 г.) . В: Чистая и прикладная химия , 1996, т. 68, № 12, стр. 2203-2204. DOI : .
- Д. Хеллвинкель: Систематическая номенклатура органической химии. 5-е издание, Springer, 2005 г., ISBN 3-540-26411-6 , стр. 188.
- М. Томоэда, Р. Китамура: Цис-транс-изомеризующая активность Escherichia coli. Изомеризация 2- (2-фурил) -3-цис- (5-нитро-2-фурил) акриламида (фурилфурамида) до его транс-изомера . В: Biochimica et Biophysica Acta (BBA) — Enzymology , 1977, Volume 480, No. 1, pp. 315-325. DOI : .
- B. Kalyanaraman, Ronald P. Mason, Roger Rowlettb. LD Kispert: Исследование электронного спинового резонанса и расчет молекулярных орбиталей промежуточного анион-радикала в ферментативной цис-транс-изомеризации фурилфурамида, нитрофуранового производного этилена . В: Biochimica et Biophysica Acta (BBA) — Enzymology , 1981, Volume 660, No. 1, pp. 102-109. DOI : .
- Альберт Госсауэр: Структура и реакционная способность биомолекул , Verlag Helvetica Chimica Acta, Цюрих, 2006, стр. 102, ISBN 978-3-906390-29-1 .
- Паула Юрканис Брюс , Оливер Райзер : Органическая химия Pearson Education, Мюнхен 2007, ISBN 9783827371904 , стр. 159-е.
- Майкл В. Тауш : Фотохимические цис-транс-изомеризации Der Mathematische und Naturwissenschaftlichen Studium, (MNU), 40:92, URL: /fileadmin/Chemie/chemied…ublications/mnu_40_87.pdf
Виды изомерии в органической химии
В классификации изомерии выделяют два основных типа изомеров:
- структурные;
- пространственные.
Структурная изомерия
Выделяют несколько видов изомерии по структуре молекулы.
1. Изомерия углеродной цепи.
Углеродная цепь или углеродный скелет представляет собой остов молекулы, состоящий из углеродных атомов. Если порядок соединения атомов углерода в молекуле отличается, то вещества являются структурными изомерами по углеродной цепи.
Так, пентану C5H12, относящемуся к ряду алканов, свойственны три структурные формулы изомеров.
2. Валентная изомерия.
Валентные изомеры различаются распределением химических связей внутри молекулы. К примеру, для бензола (C6H6), помимо стандартной молекулы в форме плоского шестиугольника, известно еще три валентных изомера. Они представлены на изображении ниже.
3. Изомерия положения функциональной группы.
В молекулах органических соединений, не относящихся к классу углеводородов, можно выделить две составляющие части: углеводородный фрагмент (радикал) и функциональная группа.
Функциональная группа — фрагмент органического соединения, определяющий его свойства и принадлежность к определенному классу органических соединений. Например, -CN — цианогруппа (функциональная группа класса нитрилов), -OH — гидроксильная группа (функциональная группа спиртов и фенолов).
Изомеры положения функциональной группы отличаются расположением функциональной группы в молекулах. В качестве примера рассмотрим изомеры хлорпентана — вещества, относящегося к классу галогенпроизводных углеводородов. В хлорпентане функциональной группой является -Cl. Его изомеры, отличающиеся положением функциональной группы:
4. Межклассовая изомерия.
Межклассовые изомеры — вещества, имеющие одинаковый количественный и качественный состав, но относящиеся к различным классам органических соединений. Поскольку молекулы таких изомеров содержат различные функциональные группы, такой вид изомерии также называют изомерией функциональной группы.
Спирты (соединения с функциональной группой -ОН) изомерны простым эфирам (веществам с функциональной группой -О-). Например, этанол является межклассовым изомером диметилого эфира:
5. Изомерия положения кратной связи
Подобно изомерии положения функциональной группы, изомеры данного вида отличаются расположением элемента в углеродной цепи. В данном случае такой элемент — кратная связь. Рассмотрим изомеры бутена по положению двойной связи:
СН–СН–СН=СН — это бутен-1
СН–СН=СН–СН — это бутен-2
Пространственная изомерия (стереоизомерия)
Структурные формулы пространственных изомеров могут быть одинаковыми, но молекулы при этом будут отличаться расположением атомов в пространстве, т.е. будут иметь различные пространственные формулы. Химики выделяют два вида пространственной изомерии:
- оптическая (энантиомерия);
- геометрическая (цис- и трансизомеры).
Рассмотрим подробнее каждый из типов.
1. Оптическая изомерия (энантиомерия).
Оптическую изомерию также называют зеркальной. Оптические изомеры (энантиомеры) — это молекулы, которые являются зеркальными отражениями друг друга. Такой вид изомерии возникает, когда у одного атома углерода появляется четыре разных заместителя. Эти атомы углерода называются ассиметрическими, или хиральными (от греч. хиро — рука, поскольку наши руки также являются зеркальными отражениями друг друга). Таким образом оптические изомеры различаются порядком расположения заместителей вокруг асимметричного центра. На практике такие изомеры различаются по направлению вращения плоскости поляризации плоскополяризованного света. Один из оптических антиподов является правовращающим (вращает плоскость поляризации вправо, его обозначают знаком «+»), а другой — левовращающим (вращает плоскость поляризации влево, обозначают знаком «−»).
Оптическая изомерия характерна для многих классов природных органических соединений (углеводов, аминокислот). Например, на рисунке представлены оптические изомеры аминокислоты аланина:
2. Геометрическая изомерия.
Геометрическая изомерия также называется цис,транс-изомерией, показывает разное положение заместителей относительно цикла или двойной связи.
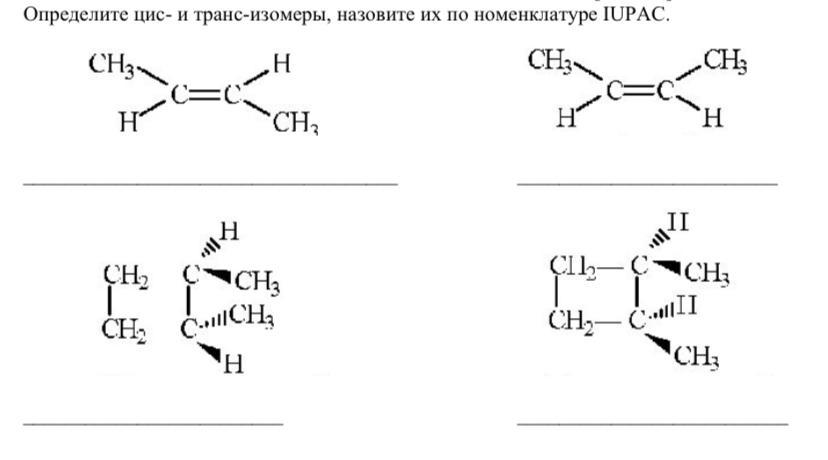
Когда заместители находятся по одну сторону двойной связи (плоскости цикла), то вещество называют цис-изомером. Если заместители расположены по разные стороны, то речь идет о транс-изомерах. Пример — это цис-бутен-2 и транс-бутен-2.
На изображении ниже транс-бутен-2 представлен слева, а цис-бутен-2 — справа.
Оптические изомеры
Они представляют собой зеркальные изображения, которые нельзя накладывать друг на друга; то есть, если изображение одного изомера помещается на изображение другого, положение его атомов точно не совпадает. Однако они имеют одинаковые характеристики, но отличаются взаимодействием с поляризованным светом.
В этой группе выделяются энантиомеры, которые генерируют поляризацию света в соответствии с их молекулярным расположением и подразделяются на правовращающие (если поляризация света в правом направлении плоскости) или левосторонние (если поляризация в левом направлении). самолета).
Когда имеется одинаковое количество обоих энантиомеров (d и l), итоговая или результирующая поляризация равна нулю, что известно как рацемическая смесь.
Теория строения органических соединений
Ещё в глубокой древности люди могли получать органические вещества, но теория их строения была сформулирована только в 1860-х годах русским химиком Александром Михайловичем Бутлеровым. Теория получила название в честь своего автора и стала фундаментом органической химии. До возникновения этой теории существовала такая точка зрения, что органические вещества нельзя получить из неорганических, то есть для их синтеза необходима некая сила, существующая только у живых организмов. Естественно, что появление теории, противоречащей всем знаниям в области органики, вызвало непонимание у химиков того времени. Научившись самостоятельно синтезировать органические вещества, ученые столкнулись с соединениями с одинаковой молекулярной формулой и молярной массой, но абсолютно другими свойствами. Например, диметиловый эфир при нормальных условиях представляет собой газ, а этиловый спирт, имеющий такой же состав, – жидкость. Подобные соединения стали называть изомерами, а явление – изомерией.
Изомеризация
Химические превращения, в результате которых структурные изомеры превращаются друг в друга, называется изомеризацией
Такие процессы имеют важное значение в промышленности. Так, например, проводят изомеризацию нормальных алканов в изоалканы для повышения октанового числа моторных топлив; изомеризуют пентан в изопентан для последующего дегидрирования в изопрен. Изомеризацией являются и внутримолекулярные перегруппировки, из которых большое значение имеет, например, перегруппировка Бекмана — превращение циклогексаноноксима в капролактам (сырьё для производства капрона).
Изомеризацией являются и внутримолекулярные перегруппировки, из которых большое значение имеет, например, перегруппировка Бекмана — превращение циклогексаноноксима в капролактам (сырьё для производства капрона).
Процесс взаимопревращения энантиомеров называется рацемизацией: она приводит к исчезновению оптической активности в результате образования эквимолярной смеси (−)- и (+)-форм, то есть рацемата. Взаимопревращение диастереомеров приводит к образованию смеси, в которой преобладает термодинамически более устойчивая форма. В случае π-диастереомеров это обычно транс-форма. Взаимопревращение конформационных изомеров называется конформационным равновесием.
Явление изомерии в огромной степени способствует росту числа известных (и ещё в большей степени — числа потенциально возможных) соединений. Так, возможное число структурно-изомерных дециловых спиртов — более 500 (известно из них около 70), пространственных изомеров здесь более 1500.
При теоретическом рассмотрении проблем изомерии все большее распространение получают топологические методы; для подсчёта числа изомеров выведены математические формулы.
Материал для производства пластмасс
Бутены представляют собой алкены с четырьмя атомами углерода, C4H8. Существует несколько различных структурных или конфигурационных изомеров бутена, в том числе геометрические и оптические изомеры. Все четыре бутена имеют схожие физические свойства, будучи бесцветными газами, тяжелыми в воде, хорошо растворимы в эфире и алканах. Различия в физических свойствах объясняются структурой молекул. Например, cis-But-2-en имеет более высокую температуру кипения, чем trans-But-2-en, потому что он является более сильным диполем.
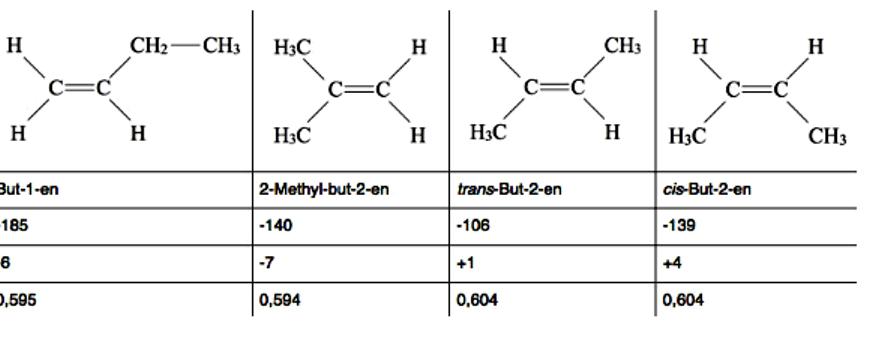
Две алкильные группы цис-изомера работают со своим + I эффектом в одном направлении и тем самым усиливают, в то время как две алкильные группы транс-изомеров действуют в противоположных направлениях и, таким образом, ослабляют друг друга. Формулы углеводородов имеющих геометрические изомеры, указывают по стандартам IUPAC. But-1-en имеет такую низкую точку плавления, так как CC одинарная связь между вторым и третьим атомом углерода свободное вращения и этильная группа может, вращаться вокруг оси поворота во всех направлениях.
Это затрудняет классификацию молекулы в твердую кристаллическую структуру. Остальные три бутена с двойной связью между 2-м и 3-м атомом C, очень жесткие и могут быть легко классифицированы в кристаллической структуре. Поэтому они имеют относительно высокие температуры плавления. Эти аргументы не всегда действительны, так как на примере показан 2-Methyl-but-2-en (или изобутен). Две метильные группы с их + I-эффектами действуют в том же направлении, что и cis-But-2-en, и на самом деле должны быть улучшены. Тем не менее изобутен имеет очень низкую температуру кипения только -7 °C.
But-1-en и But-2-ene, используются для получения бутадиена и бутан- 2-ol. Кроме того, алкены используются в качестве алкилирующих агентов. Таким образом, из изобутена и изобутана получают важный топливный 2,2,4-Trimethyl-pentan, более известный как изооктан. Наконец, бутены являются исходными материалами для производства некоторых пластмасс, поскольку их легко полимеризовать. Известный пластик на But-1-en основе, является полибутеном-1, из которого производятся трубы.
Пространственная
Данный вид классифицируется на две группы:
- оптическую или зеркальную изомерию;
- геометрическую изомерию.
Суть оптической изомерии заключается в зеркальном отражении молекул. Изомеры будто отражают друг друга.
Геометрическая изомерия подразделяется на два типа:
- цис-изомерию – радикалы располагаются по одну сторону условной плоскости, разделяющей молекулу пополам;
- транс-изомерию – радикалы лежат по разным сторонам условной плоскости.
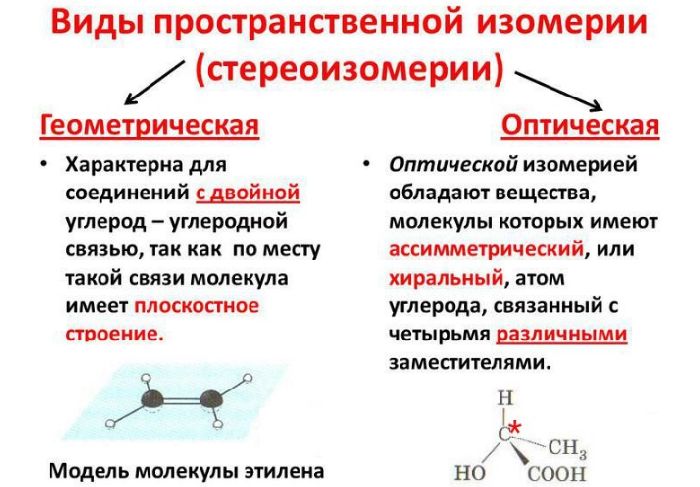
Рис. 3. Оптическая и геометрическая изомерия.
Изомеры пространственной изомерии называются стереоизомерами или пространственными изомерами. Зеркальные молекулы называются энантиомерами. Если молекулы не отражают друг друга, они называются диастереомерами или геометрическими изомерами.
Изомерия в неорганической химии
В неорганических соединениях, особенно в координационных комплексах, присутствует несколько типов изомерии , но это явление не так важно, как в органической химии
- Структурная или топологическая изомерия : Атомы соединены по-разному, как в S 2 F 2 , из которых одна молекула имеет форму цепочки, а другая — форму треугольной пирамиды. Частным случаем является таутомерия , при которой атом H меняет положение.
- Конформационная изомерия : То же, что уже упоминалось для органических соединений. Это происходит в соединениях с одинарной связью, таких как P 2 H 4 или дитионит-ион, S 2 O 4 2- , где есть затемненная, шахматная и синклинальная (гош) формы.
- Цис-транс (геометрическая) изомерия : появляется в таких соединениях, как азотистая кислота , HNO 2 , или в плоскоквадратных координационных комплексах, таких как [PtCl 2 (NH3) 2
- Позиционная изомерия , как у некоторых гетероциклов серы и азота . В S 6 (NH) 2 октагональное кольцо серы сохраняется, но два атома серы заменены группами NH, которые могут находиться в положении 1,2; 1,3; 1.4 и 1.5.
- Оптическая изомерия : также проявляется в координационных соединениях тетраэдрической структуры с разными заместителями.
- Изомерия ионизации : лиганд катиона заменяется одним из анионов, которые его нейтрализуют, как это происходит между [CrSO 4 (NH 3 ) 5 ]Cl и [CrCl(NH 3 ) 5 ]SO 4
-
Координационная изомерия : если оба иона являются сложными, мы можем обменять их лиганды и получить разные изомеры, как это происходит между [Co(NH 3 ) 6 ][Cr(CN) 6 ] [Cr(NH 3 ) 6 ][Co(CN) 6Изомерия связи в комплексе кобальта.
- Изомерия связи : некоторые лиганды могут по-разному связываться с центральным ионом, как в [CoCl(NO 2 )(NH 3 ) 4+ [CoCl(ONO)(NH 3 ) 4+
- Полимеризационная изомерия : это случай NO 2 и N 2 O 4 , двух газообразных оксидов азота.
Взаимное влияние атомов в молекулах
С момента появления электронной теории химической связи (1912-1916 гг.) знания о структуре химических соединений, как о последовательности соединенных атомов, были значительно пополнены. Данная теория объясняет причину влияния атомов или групп атомов внутри молекулы друг на друга. Всего существует два способа такого взаимодействия.
Индуктивный эффект
Индуктивный эффект – смещение электронной плотности по σ (сигма) связям, вследствие которого происходит перераспределение эффективных зарядов на атомах в молекуле. Эффект передается с постепенным затуханием, поэтому через 3 связи становится практически равным 0. Индуктивный эффект бывает положительным (+I) или отрицательным (-I). Положительный эффект замечается при увеличении электронной плотности заместителем, а отрицательный, наоборот, при уменьшении. Заместители, атомы которых более электроотрицательны, чем атом углерода, будут проявлять отрицательный индуктивный эффект (атомы галогенов, гидроксогруппы, аминогруппы, нитрогруппы и др). В таком случае на атоме углерода образуется δ+ (частично положительный) заряд, а на атоме заместителя – δ-(частично отрицательный). Положительный эффект проявляют атомы с низкой электроотрицательностью (чаще всего металлы), а также углеводородные радикалы (CH3 и др). При таком раскладе на атоме углерода будет δ- заряд, а на атоме заместителя – δ+.
Мезомерный эффект
Мезомерный эффект – смещение общей электронной плотности по цепи сопряженных π (пи) связей. Мезомерный эффект не затухает по системе кратных связей и p-орбиталей, чем отличается от индуктивного. Этот эффект может быть положительным (М+) или отрицательным (М-). Положительный мезомерный эффект бывает только у C=C связей с некоторыми заместителями: аминогруппами, гидроксогруппами, галогенами. А отрицательный у карбоксильных групп, нитрогрупп, сульфогрупп и др. Из-за мезомерного эффекта на атомах заместителей соответсвенно возникает частично положительный или частично отрицательный заряд. Заметнее всего этот эффект в производных бензола, так как распределение зарядов в бензольном кольце является следствием действия и индуктивного и мезомерного эффектов.
Изомерия положения.
Другой вид структурной изомерии – изомерия положения возникает в тех случаях, когда функциональные группы, отдельные гетероатомы или кратные связи расположены в различных местах углеводородного скелета. Структурные изомеры могут принадлежать к разным классам органических соединений, поэтому они могут различаться не только физическими, но и химическими свойствами. На рис. 5 показаны три изомера для соединения С3Н8О, два из них – спирты, а третье – простой эфир

Рис. 5. Изомеры положения
Нередко различия в строении изомеров положения столь очевидны, что не требуется даже мысленно совмещать их в пространстве, например, изомеры бутена или дихлорбензола (рис. 6):
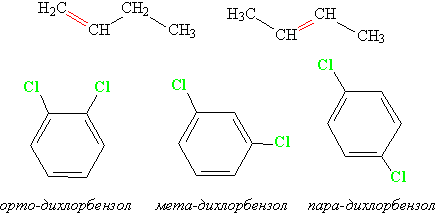
Рис. 6. Изомеры бутена и дихлорбензола
Иногда структурные изомеры сочетают признаки изомерии углеводородного скелета и изомерии положения (рис. 7).
Рис. 7. Сочетание двух видов структурной изомерии
В вопросах изомерии теоретические рассмотрения и эксперимент взаимосвязаны. Если рассмотрения показывают, что изомеров быть не может, то эксперименты должны показывать то же. Если вычисления указывают на определенное число изомеров, то их может быть получено столько же, или меньше, но не больше – не все теоретически рассчитанные изомеры могут быть получены, поскольку межатомные расстояния или валентные углы в предполагаемом изомере могут выходить за пределы допустимого. Для вещества, содержащего шесть групп СН (например, бензол), теоретически возможно 6 изомеров (рис. 8).

Рис. 8. Изомеры бензола
Первые пять из показанных изомеров существуют (второй, третий, четвертый и пятый изомеры были получены спустя почти 100 лет, после того, как было установлено строение бензола). Последний изомер, скорее всего, никогда не будут получен. Представленный в виде шестиугольника, он наименее вероятен, его деформации приводят к структурам в форме скошенной призмы, трехлучевой звезды, незавершенной пирамиды и сдвоенной пирамиды (незавершенному октаэдру). Каждый из этих вариантов содержит либо весьма различающиеся по величине связи С-С, либо сильно искаженные валентные углы (рис. 9):
Химические превращения, в результате которых структурные изомеры превращаются, друг в друга, называют изомеризацией.
Стереоизомерия
В пространственных изомерах с одинаковой структурной формулой, атомы молекулы ориентированы в пространстве по-разному.
Чем же отличается структурная изомерия от пространственной: первая рассматривает порядок атомов в молекуле на плоскости, а вторая – в объеме.
Стереоизомерия делится на геометрическую (цис-транс) и оптическую.
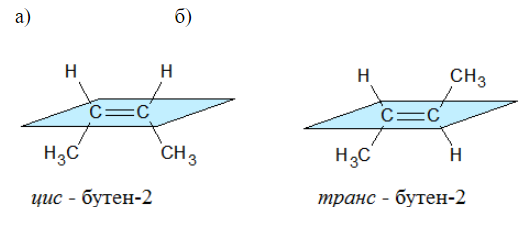
Цис-транс — изомерия (геометрическая)
Геометрические изомеры присутствуют в веществах, имеющих двойные связи или циклы.
Подразделяют геометрические изомеры относительно плоскости, в которой расположена π-связь или закольцованный цикл.
Изомеры, у которых одинаковые заместители расположены по одну сторону от плоскости называют цис- изомерами.
Соединения, у которых заместители расположены по разные стороны от плоскости π-связь или кольца называют транс- изомерами.
Наглядной иллюстрацией могут служить простейшие геометрические изомеры — бутен-:
Оптическая изомерия
При исследовании веществ с одинаковой структурной формулой на поляриметре было выявлено явление вращения плоскости поляризованного света. Такие вещества получили название оптически активных веществ.
Исследования показали, что молекулы этих веществ хиральны, то есть несовместимы со своим отражением в зеркале. Хиральные вещества присутствуют в виде двух оптических антиподов (энантиомеров), один из которых правовращающий (+), а другой – левовращающий (-).
Определить знак оптического изомера можно с помощью поляриметра.
Причина хиральности состоит в присутствии ассиметрического атома углерода – связанного с четырьмя различными заместителями.
Хиральные молекулы невозможно совместить, так как они зеркально симметричны.
Пример пары стереоизомеров, представляющих зеркальные отражения:
(S)-(+)- Молочная кислота (слева) и (R)-(-)-Молочная кислота (справа).
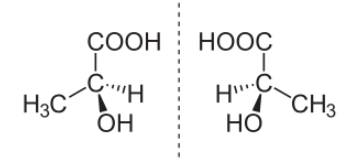
Для изображения оптических изомеров используют проекционные формулы Э.Фишера.
Отличие в свойствах
Разная пространственная форма молекул влияет на физические свойства веществ. У различных геометрических форм будут отличаться:
- точка кипения;
- точка плавления;
- растворимость .
Влияние на различие свойств пространственных изомеров оказывает природа функциональных групп и то, какое расстояние между ними. Если заместители представлены слабыми донорами, их влияние на свойства вещества будет несильным. Например, цис — и транс пентен — 2 почти не отличаются по физическим свойствам, потому что водород замещают метильная и этильная группы.
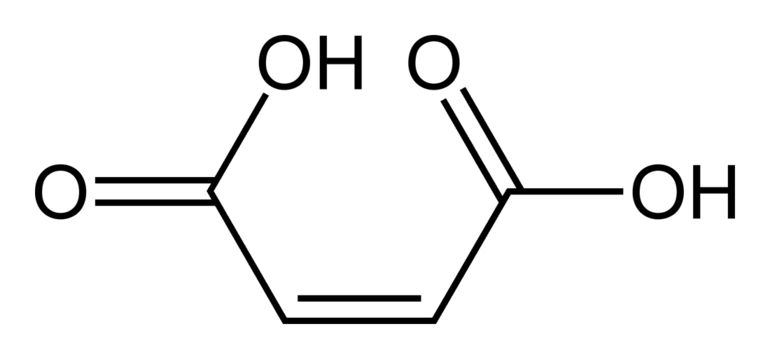
Но если есть полярная группа, влияющая на двойную связь, свойства пространственных форм существенно отличаются. Например, малеиновая кислота по физическим свойствам и химической активности сильно отличается от фумаровой. Но обе они являются изомерными формами бутендиовой кислоты. Это связано с тем, что у цис — изомера расстояние между функциональной группой и радикалом меньше, чем у транс — изомера.
Пространственная изомерия (стереоизомерия)
Основная статья: Стереоизомеры
Пространственная изомерия (стереоизомерия) возникает в результате различий в пространственной конфигурации молекул, имеющих одинаковое химическое строение. Для обозначения пространственных изомеров разных типов разработана стереохимическая номенклатура, собранная в разделе E номенклатурных правил ИЮПАК по химии[источник не указан 3511 дней].
Этот тип изомерии подразделяют на энантиомерию (оптическую изомерию) и диастереомерию.
Энантиомерия (оптическая изомерия)
Основная статья: Оптическая изомерия
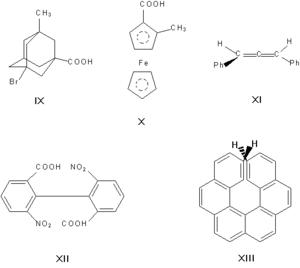
Энантиомерами (оптическими изомерами, зеркальными изомерами) являются пары оптических антиподов — веществ, характеризующихся противоположными по знаку и одинаковыми по величине вращениями плоскости поляризации света при идентичности всех других физических и химических свойств (за исключением реакций с другими оптически активными веществами и физических свойств в хиральной среде). Необходимая и достаточная причина возникновения оптических антиподов — принадлежность молекулы к одной из следующих точечных групп симметрии: Cn, Dn, T, O или I (хиральность). Чаще всего речь идёт об асимметрическом атоме углерода, то есть об атоме, связанном с четырьмя разными заместителями.
Асимметрическими могут быть и другие атомы, например атомы кремния, азота, фосфора, серы. Наличие асимметрического атома — не единственная причина энантиомерии. Так, имеют оптические антиподы производные адамантана (IX), ферроцена (X), 1,3-дифенилаллена (XI), 6,6′-динитро-2,2′-дифеновой кислоты (XII). Причина оптической активности последнего соединения — атропоизомерия, то есть пространственная изомерия, вызванная отсутствием вращения вокруг простой связи. Энантиомерия также проявляется в спиральных конформациях белков, нуклеиновых кислот, в гексагелицене (XIII).
Диастереомерия
Диастереомерными считают любые комбинации пространственных изомеров, не составляющие пару оптических антиподов. Различают σ- и π-диастереомеры.
σ—диастереомерия
σ-диастереомеры отличаются друг от друга конфигурацией части имеющихся в них элементов хиральности. Так, диастереомерами являются (+)-винная кислота и мезо-винная кислота, D-глюкоза и D-манноза, например:
π—диастереомерия (геометрическая изомерия)
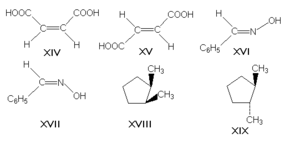
π-диастереомеры, называемые также геометрическими изомерами, отличаются друг от друга различным пространственным расположением заместителей относительно плоскости двойной связи (чаще всего С=С и С=N) или цикла. К ним относятся, например, малеиновая и фумаровая кислоты (формулы XIV и XV соответственно), (Е)- и (Z)-бензальдоксимы (XVI и XVII), цис- и транс-1,2-диметилциклопентаны (XVIII и XIX).
Изомерия в химии — что это за явление
В современной естественной науке важно обращать внимание на такое явление как изомерия. Без понимания свойств веществ-изомеров почти невозможно изучать законы и закономерности химии.
Впервые на явление изомерии обратили внимание двое ученых в 1823 году
Ю. Либих и Ф. Велер поспорили из-за различий в свойствах фульмината серебра (AgCNO). Ученые заметили, что у циановокислого и гремучего серебра одна и та же формула
Впервые на явление изомерии обратили внимание двое ученых в 1823 году. Ю
Либих и Ф. Велер поспорили из-за различий в свойствах фульмината серебра (AgCNO). Ученые заметили, что у циановокислого и гремучего серебра одна и та же формула.
Подробнее явление изучил Й. Берцелиус. Исследовав винную и виноградные кислоты (у обеих формулаC4H6O6) он в 1830 году ввел термин «изомерия». Его предположение заключалось в следующем: вещества с одинаковым составом могут различаться из-за разного распределения атомов в молекуле.
Наконец, во второй половине XIX века Я. Вант-Гофф открыл пространственную изомерию, а А. Бутлеров — структурную изомерию. Так сформировалась современная теория изомерии.
Определение понятия
Из данного определения следует определение веществ-изомеров.
Важно не путать изомеры с гомологическими веществами. Гомологи также имеют сходное строение и свойства, но различаются по составу (и, соответственно, формуле) на целое число групп CH2
Что такое органическая химия?
Органическая химия – это раздел химии, который изучает структуру, свойства и методы получения (синтеза) углеводородов и их производных. Сейчас число известных органических соединений составляет почти 30 млн, однако оно продолжает расти (в мае 1999 года было известно около 12 млн органических веществ). Этот рост обусловлен необычными свойствами углерода. Например, данный элемент может образовать цепи любой длины, способные замыкаться и образовывать циклы, а также атом углерода способен создавать одинарные, двойные или тройные связи. Валентность углерода всегда равна 4-м, поэтому он всегда будет создавать вокруг себя 4 связи. Это могут быть четыре одинарных, две двойных, одна тройная и одна одинарная и др. В любом случае, способов образовывать связи много, однако чаще всего углерод связывается с водородом, кислородом, фосфором, азотом и некоторыми другими атомами этих элементов.
Типы изомеров
Как указано выше, представлены два типа изомеров, которые различаются упорядочением своих атомов. Типы изомеров следующие:
Конституционные изомеры (структурные)
Те соединения, которые имеют одинаковые атомы и функциональные группы, но расположены в другом порядке; то есть ссылки, составляющие их структуры, имеют различное расположение в каждом соединении.
Они делятся на три типа: позиционные изомеры, цепные или скелетные изомеры и изомеры функциональных групп, иногда называемые функциональными изомерами.
Цепные или скелетные изомеры
Они отличаются распределением углеродных заместителей в соединении, то есть тем, как они распределены линейно или разветвленно.
Функциональные группы изомеров
Также называемые функциональными изомерами, они состоят из одинаковых атомов, но они образуют разные функциональные группы в каждой молекуле..
таутомерия
Существует исключительный вид изомерии, который называется таутомерия, в которой происходит взаимопревращение одного вещества в другое, которое обычно происходит путем переноса атома между изомерами, вызывая баланс между этими видами.
Стереоизомеры (пространственные изомеры)
Это называется так для веществ, которые имеют абсолютно одинаковую молекулярную формулу и чьи атомы расположены в одном и том же порядке, но чья ориентация в пространстве отличается между одним и другим. Поэтому для обеспечения их правильной визуализации они должны быть представлены в трехмерном виде..
В общих чертах существует два класса стереоизомеров: геометрические изомеры и оптические изомеры..
Геометрические изомеры
Они образуются путем разрыва химической связи в соединении. Эти молекулы представлены парами, которые отличаются по своим химическим свойствам, поэтому для их дифференциации были установлены термины цис (специфические заместители в соседних положениях) и транс (специфические заместители в противоположных положениях его структурной формулы)..
В этом случае выделяются диастереомеры, которые имеют разные конфигурации и не являются наложенными друг на друга, каждый со своими характеристиками. Также обнаружены конформационные изомеры, образованные вращением заместителя вокруг химической связи.
Оптические изомеры
Это те, которые составляют зеркальные изображения, которые не могут перекрываться; то есть, если изображение изомера размещено на изображении другого, положение его атомов не совпадает точно. Тем не менее, они имеют одинаковые характеристики, но отличаются от их взаимодействия с поляризованным светом.
В этой группе выделяются энантиомеры, которые генерируют поляризацию света в соответствии с их молекулярным расположением и различаются как правовращающие (если поляризация света находится в правильном направлении плоскости) или левовращающие (если поляризация в левом направлении) самолета).
Когда имеется одинаковое количество обоих энантиомеров (d и l), чистая поляризация или результирующая величина равна нулю, что известно как рацемическая смесь.
Заключение
Органическая химия играет большую роль в существовании живых организмов. С давних времен люди пытались разгадать тайны органических веществ, но стремительно развиваться этот раздел химии начал только в середине XIX века. Разгадав тайны строения этих соединений, люди продолжили двигаться вперед, открывая новое и в большинстве случаях полезное для человечества (например, препарат пенициллин). Прочитав данную статью, вы узнали о теории А.М. Бутлерова, о таких явлениях как гомология и изомерия и о взаимном влиянии атомов в молекулах. Все эти открытия, сделанные людьми несколько столетий назад, являются основами органической химии по сей день.
Смотри также:
- Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа
- Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная)
- Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола)